Page 160 - 201810
P. 160
·1768· 精细化工 FINE CHEMICALS 第 35 卷
2+ 2+
到一定值时,Ca 、Mg 水解,开始生成 Ca(OH) 2
2+
和 Mg(OH) 2 ;Ca 生成 Ca(OH) 2 的 pH 在 10~11,pH
+
达到 12 之后 Ca(OH) 2 总量上升缓慢、Ca(OH) 出现
2+
下降趋势;Mg 生成 Mg(OH) 2 的 pH 在 11~12,并
+
随着 pH 增大其浓度迅速上升,此时,Mg(OH) 不再
+
随 pH 上升而增大。由于生成的 Ca(OH) 、Mg(OH) +
2+
2+
在岩石表面的吸附能力比 Ca 、Mg 更强,导致模
拟岩石表面的负电荷量减少,其 Zeta 电位绝对值出现
减小的趋势。然而,对带负电原油的吸附可能性增加。
图 2 模拟岩石/NaCl(CaCl 2 、MgCl 2 )盐水界面 Zeta 电位
与 pH 关系
Fig. 2 Relationship between Zeta potential of simulated
rock/NaCl (CaCl 2 , MgCl 2 ) brine interface and pH
of solution
由图 2 可见,在 NaCl 溶液中,模拟岩石颗粒表
面的 Zeta 电位绝对值随 pH 增加而逐渐增大。当 pH
由 3 增到 9 时,其 Zeta 电位由8 mV 增到37.8 mV。
主要原因是:在盐水溶液中,岩石颗粒中的晶体结
构发生晶格破碎与溶蚀作用,导致模拟岩石表面显
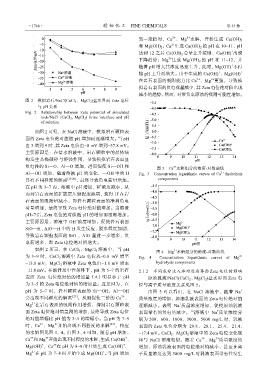
负电性的 Si—O、Al—O 增加,进而促使 Si—OH 和 图 3 Ca 水解组分的浓度-对数曲线
2+
Al—OH 增加,随着溶液 pH 的变化,—OH 中的 H Fig. 3 Concentration logarithmic curves of Ca hydrolysis
2+
具有不同程度的解离 [19-20] ,最终导致负电荷量增加。 components
+
在 pH 为 3~7 内,溶液中 pH 增加,H 浓度减小,从
+
而对岩石表面的扩散层压缩程度减弱,使得 H 在岩
石表面的吸附量减小,即岩石颗粒表面的净剩负电
荷量增加,最终导致 Zeta 电位绝对值增加。当溶液
pH7 后,Zeta 电位绝对值随 pH 的增加而逐渐增加。
主要原因是,溶液中 OH 浓度增加,促使岩石表面
SiO—H、AlO—H 中的 H 发生反应、脱水程度加剧,
导致岩石颗粒表面的 SiO 、AlO 量进一步增多,负
电荷增多,即 Zeta 电位绝对值增大。
如图 2 所示,在 CaCl 2 、MgCl 2 溶液中,当 pH 2+
图 4 Mg 水解组分的浓度-对数曲线
为 3~9 时,CaCl 2 溶液中 Zeta 电位从0.8 mV 增至 Fig. 4 Concentration logarithmic curves of Mg
2+
13.8 mV;MgCl 2 溶液中 Zeta 电位由1.8 mV 增至 hydrolysis components
11.8 mV。在酸性及中性条件下,pH 为 5~7 的岩石 2.1.2 不同成分注入水对原油界面 Zeta 电位的影响
表面 Zeta 电位绝对值的增加量(Δ)明显小于 pH 原油乳液/NaCl(CaCl 2 、MgCl 2 )盐水界面 Zeta 电
为 3~5 的 Zeta 电位绝对值的增加量。这是因为,在 位与离子质量浓度关系见图 5。
pH 为 5~7 时,岩石颗粒表面的 Si—OH,Al—OH 由图 5 可以看出,在 NaCl 溶液中,随着 Na +
2+
会出现不同程度的解离 [21] 。从而促使二价的 Ca 、 质量浓度的增加,原油乳液表面的 Zeta 电位绝对值
2+
+
Mg 在岩石表面的吸附作用增强,抑制岩石颗粒表 逐渐减小。表明 Na 质量浓度增加,促使原油乳液
面 Zeta 电位绝对值急剧的增加,最终导致 Zeta 电位 表面带有的负电量减少。当溶液中 Na 质量浓度分
+
绝对值增幅比 pH 值为 3~5 的增幅小。当 pH 为 7~9 别为 200、600、1000、3000、5000 mg/L 时,乳液
2+
2+
时,Ca 、Mg 开始出现不同程度的水解 [22] ,相应 表面的 Zeta 电位分别为29.8、28.1、25.4、21.4、
的水解图见图 3、4。由图 3、4 可知,随着 pH 增加, 17.4 mV。CaCl 2 、MgCl 2 溶液中的 Zeta 电位变化规
2+
2+
+
2+
Ca 和 Mg 开始出现不同程度的水解,生成 Ca(OH) 、 律与 NaCl 溶液相似。随着 Ca 、Mg 质量浓度的
2+
+
2+
+
Mg(OH) ,Ca 在 pH 为 8~9 时开始生成 Ca(OH) 、 增加,原油乳液表面的电位绝对值减小,甚至在离
2+
+
Mg 在 pH 为 7~8 时开始生成 Mg(OH) 。当 pH 增加 子质量浓度达到 5000 mg/L 时乳液表面带电性发生