Page 186 - 《精细化工》2020年第5期
P. 186
·1036· 精细化工 FINE CHEMICALS 第 37 卷
表 4 苯酚溶液初始 pH 对铁溶出量、苯酚降解率及一级 解苯酚效果的影响。
动力学常数的影响
Table 4 Effect of initial pH of phenol solution on the dissolution
amount of Fe, phenol degradation rate and first-order
kinetic constant
苯酚初始 总铁离子溶 苯酚降 –1 2
k/h R
溶液 pH 出量/(mg/L) 解率/%
2.06 1.663 94.66 0.55520 0.90380
3.00 1.030 98.55 0.73108 0.96571
5.00 0.856 98.16 0.73468 0.94885
7.00 0.202 97.38 0.70620 0.91504
9.00 0.417 97.38 0.65713 0.94818
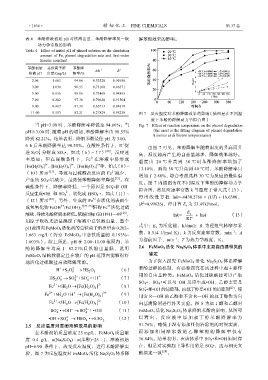
11.00 0.513 82.21 0.27829 0.98238 图 7 反应温度对苯酚降解效果的影响(插图是在不同温
度下苯酚的降解动力学拟合图)
当 pH<3.00 时,苯酚降解率降低至 94.66%;当 Fig. 7 Effect of reaction temperature on the phenol degradation
pH≥3.00 时,随着 pH 的增加,苯酚降解率由 98.55% (the inset is the fitting diagram of phenol degradation
kinetics at different temperatures)
降到 82.21%。结果表明,降解苯酚最佳 pH 为 3.00,
+
6 h 后苯酚降解率达 98.55%。在酸性条件下,H 促 由图 7 可见,苯酚降解率随着温度的升高而升
–
2–
进 S 2 O 8 分解成 SO 4 •,如式(6)~(7) [20] ,反应速 高,温度越高产生的自由基越多,降解效果越好。
2+
率增加;但在强酸条件下,Fe 在溶液中易形成 温度由 20 ℃升高到 30 ℃时苯酚降解率增加了
2+
3+
2+
[Fe(H 2 O) 6 ] 、[Fe(H 2 O) 6 ] 、[Fe(H 2 O) 5 ] 等,如式(8)~ 13.10%,而由 30 ℃升高到 40 ℃时,苯酚降解率只
2+
(10)所示 [21] ,导致与过硫酸盐反应的 Fe 减少, 增加了 2.80%,综合考虑选择 30 ℃为反应的最佳温
–
产生的 SO 4 •量减少,最终使苯酚降解率降低 [22] 。在 度。图 7 内插图为在不同温度下苯酚的降解动力学
–
碱性条件下,降解率降低,一个原因是 SO 4 •和 OH – 拟合图,将反应速率常数 k 与温度 T 带入式(13),
2–
–
反应生成•OH 和 SO 4 ,转化成 HSO 4 •,如式(11)~ 得 出线性 方程 lnk=6438.2766×(1/T)﹢16.6300,
3+
(12)所示 [23] ;另外,生成的 Fe 在活化剂表面生 2
2+ +[24-25] 2+ (R =0.99626),经计算 E a 为 53.49kJ/mol。
成氢氧化物 FeOH /Fe(OH) 2 阻碍 Fe 活化过硫
酸盐,导致苯酚降解率降低。依据国标 GB11911—89 [26] , ln = k E a lnA (13)
用原子吸收光谱法测定了溶液中总铁溶出量,整个 RT
式中:E a 为活化能,kJ/mol;R 为理想气体摩尔常
pH 范围内FeMoO 4 活化剂的总铁离子溶出量在0.202~
–1
数,8.314 J/(mol·K);k 为反应速率常数,min ;A
1.663 mg/L(约为 FeMoO 4 中总铁质量的 0.193%~
–1
1.603%)。综上所述,pH 在 2.00~11.00 范围内,苯 为指前因子,min ;T 为热力学温度,K。
酚的降解率均高于 82.21%且铁溶出量低,说明 2.6 FeMoO 4 活化 Na 2S 2O 8 体系中主要自由基种类的
FeMoO 4 结构较稳定且在较广的 pH 范围内能够很好 鉴定
地活化过硫酸盐高效降解苯酚。 为了深入探究 FeMoO 4 活化 Na 2 S 2 O 8 体系降解
+
H +S O 2 8 HS O 2 8 (6) 苯酚过程的机制,有必要探究在该过程中起主要作
2
2
HS O SO +SO •+ H + (7) 用的自由基种类。FeMoO 4 活化过硫酸盐可以产生
4
8
4
2
–
–
–
SO 4 •,SO 4 •可以与 OH 反应生成•OH,乙醇主要是
2+
Fe +6HO [Fe(HO) ] 6 2+ (8) SO 4 •和•OH 的清除剂,而叔丁醇是•OH 的清除剂 ,使
–
2
[27]
2
3+
2+
Fe +6H O +H [Fe(H O) ] (9) 用含 R—OH 的乙醇和不含 R—OH 的叔丁醇作为自
6
2
2
2+
2+
Fe +5HO [Fe(HO) ] (10) 由基清除剂进行淬灭实验。图 8 为叔丁醇和乙醇对
5
2
2
SO • 4 OH SO + O• 2 4 H (11) FeMoO 4 活化 Na 2 S 2 O 8 体系降解苯酚的影响,从图可
• OH SO 2 4 HSO 4 • 0 . 5 O 2 (12) 以 看出, 反应 液中添 加叔 丁醇苯 酚降 解率 为
2.5 反应温度对苯酚降解效果的影响 91.76%,略低于没有添加任何清除剂的对照实验,
在苯酚初始质量浓度 25 mg/L、FeMoO 4 质量浓 而 添加相 同摩 尔数的 乙醇 苯酚的 降解 率仅 有
–
度 0.4 g/L、n(Na 2S 2O 8)∶n(苯酚)=25∶1、溶液初始 36.84%。结果表明,在该体系中 SO 4 •和•OH 同时存
–
pH=6.90 条件下,改变反应温度,进行苯酚降解实 在,但是对实验起主导作用的是 SO 4 •,这与相关文
验,图 7 为反应温度对 FeMoO 4 活化 Na 2S 2O 8 体系降 献描述一致 [28] 。