Page 43 - 201811
P. 43
第 11 期 李向红,等: 核桃青皮缓蚀剂的提取制备及其缓蚀性能 ·1829·
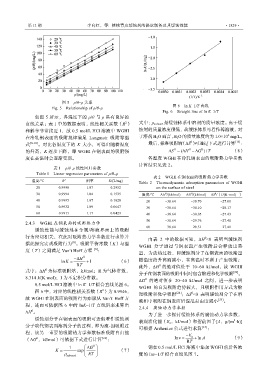
图 5 ρ/θ–ρ 关系
Fig. 5 Relationship of ρ/θ–ρ 图 6 ln K–1/T 直线
Fig. 6 Straight line of ln K–1/T
如图 5 所示,各温度下的 ρ/θ 与 ρ 具有良好的
2
直线关系;表 1 中的数据表明,线性相关系数(R ) 式中:ρ solvent 是缓蚀体系中溶剂的质量浓度。由于缓
和斜率非常接近 1,故 0.5 mol/L HCl 溶液中 WGHI 蚀剂的质量浓度很低,故缓蚀体系可看作稀溶液,对
6
在冷轧钢表面的吸附规律满足 Langmuir 吸附等温 于溶剂 H 2O 而言,H 2O 的质量浓度约为 1.0×10 mg/L。
0
式 [8-10] 。对比各温度下的 K 大小,可得出随着温度 最后,标准吸附熵(ΔS )可通过下式进行计算 [13] :
的升高,K 逐步下降,即 WGHI 在钢表面的吸附强 S 0 ( H 0 G 0 ) / T (8)
度在高温时会逐渐变弱。 各温度 WGHI 在冷轧钢表面的吸附热力学参数
计算结果见表 2。
表 1 ρ/θ–ρ 线性回归参数
Table 1 Linear regression parameters of ρ/θ–ρ
表 2 WGHI 在钢表面的吸附热力学参数
2
温度/℃ R 斜率 K/(L/mg)
Table 2 Thermodynamic adsorption parameters of WGHI
20 0.9998 1.07 0.2952 on the surface of steel
30 0.9994 1.04 0.1535 温度/℃ ΔH /(kJ/mol) ΔG /(kJ/mol) S /〔J/(K·mol) 〕
0
0
0
40 0.9995 1.07 0.1028 20 -38.64 -30.70 -27.01
50 0.9932 1.09 0.0647 30 -38.64 -30.10 -28.17
60 0.9911 1.17 0.0423 40 -38.64 -30.05 -27.43
2.4.3 WGHI 在钢表面的吸附热力学 50 -38.64 -29.76 -27.48
60 -38.64 -29.51 -27.41
缓蚀性能与缓蚀剂在金属/溶液界面上的吸附
行为密切相关,在此对吸附热力学参数进行求算并 由表 2 中的数据可知,ΔH <0 表明当缓蚀剂
0
[8]
据此探究宏观吸附行为 。吸附平衡常数(K)与温 WGHI 分子通过与钢表面产生吸附后会释放出热
度(T)之间满足 Van’t Hoff 方程 [8] :
量,为放热过程,即缓蚀剂分子在钢表面的吸附量
H 0
ln K I (6) 随温度的升高而减小,在高温时不利于产生吸附;
RT 此外,ΔH 的绝对值处于 10~60 kJ/mol,故 WGHI
0
0
式中:H 为标准吸附焓,kJ/mol;R 为气体常数, [23]
分子在钢表面的吸附中同时包含物理和化学吸附 。
8.314 J/(K·mol);I 为不定积分常数。 0
ΔG 的绝对值在 20~40 kJ/mol 之间,进一步表明
0.5 mol/L HCl 溶液中 ln K–1/T 拟合直线见图 6。 WGHI 的自发吸附趋势较大,且吸附作用方式为物
2
图 6 中,对应的线性相关系数(R )为 0.9946,
0
理吸附和化学吸附 [24] ;ΔS <0 表明缓蚀剂分子在溶
故 WGHI 在钢表面的吸附行为亦服从 Van’t Hoff 方
液相中吸附在钢表面后混乱自由度减小 [25] 。
程,进而可依据图 6 中的 lnK–1/T 直线斜率求算出 2.4.4 腐蚀动力学参数
0
H 。
为了进一步探讨缓蚀体系的腐蚀动力学参数,
缓蚀剂分子在钢表面的吸附可近似看作缓蚀剂 2
表观活化能(E a ,kJ/mol)和指前因子[A,g/(m ·h)]
分子取代钢表面溶剂分子的过程,即为液-固吸附过 [14]
可根据 Arrhenius 公式进行求算 :
程,故另一重要的吸附热力学参数标准吸附自由能 E
0
(ΔG ,kJ/mol)可依据下式进行计算 [22] : lnv RT a ln A (9)
1 G 0 钢在 0.5 mol/L HCl 溶液中添加 WGHI 前后各浓
K exp (7)
RT 度的 lnv–1/T 拟合直线见图 7。
solvent