Page 187 - 精细化工2019年第9期
P. 187
第 9 期 何云鹏,等: H 6 P 2 W 18 O 62 /MIL-101(Fe)材料的制备及其吸附性能 ·1915·
如表 4 所示,ΔG<0 说明该吸附过程是自发的,
并且是物理吸附(-20 kJ/mol <ΔG<0)的过程;ΔH>0
说明该过程是一个吸热的过程,和 Langmuir 等温吸
附模型分析一致;ΔS>0 说明固液界面的混乱度增
加,H 6P 2W 18O 62/MIL-101(Fe)对 MB 的亲和力在增大。
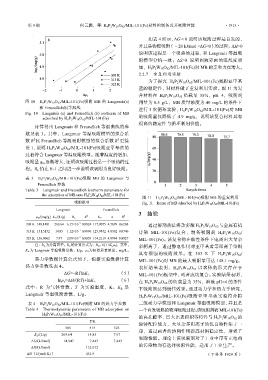
2.2.7 重复利用实验
为了探究 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附亚甲基
蓝的稳定性,对材料做了重复利用实验。图 11 为复
合材料在 H 6 P 2 W 18 O 62 负载量 35%,pH=4,吸附剂
图 10 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附 MB 的 Langmuir(a) 用量为 0.5 g/L,MB 质量浓度为 40 mg/L 的条件下
和 Freundlich(b)等温线 进行 5 次循环实验,H 6 P 2 W 18 O 62 /MIL-101(Fe)对 MB
Fig. 10 Langmuir (a) and Freundlich (b) isotherm of MB
adsorbed by H 6 P 2 W 18 O 62 /MIL-101(Fe) 的吸附量仅降低了 4.9 mg/g,说明该复合材料具有
很高的稳定性与循环利用价值。
计算得出 Langmuir 和 Freundlich 等温曲线的参
数见表 3。其中,Langmuir 等温吸附模型的拟合系
2
2
数 R 比 Freundlich 等温吸附模型的拟合系数 R 更接
近 1,说明 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附亚甲基蓝的
过程符合 Langmuir 等温吸附模型。随着温度的增加,
吸附量 q m 逐渐增大,证明该吸附过程是一个吸热的过
程。R L 值在 0~1 之间进一步说明该吸附为良好吸附。
表 3 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附 MB 的 Langmuir 与
Freundlich 参数
Table 3 Langmuir and Freundlich isotherm parameters for
the adsorption of MB onto H 6 P 2 W 18 O 62 /MIL-101(Fe)
图 11 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附 MB 的重复利用
吸附模型 Fig. 11 Reuse of MB adsorbed by H 6 P 2 W 18 O 62 /MIL-101(Fe)
Langmuir Freundlich
3 结论
2
q m/(mg/g) K L/(L/g) R L R K F n R 2
–5
303 K 148.1481 269.64 6.15×10 0.9824 117.9075 4.7699 0.6268 通过溶剂热法将杂多酸 H 6 P 2 W 18 O 62 与金属有机
–3
313 K 151.5152 14.85 1.12×10 0.9896 125.9872 4.8362 0.8746 骨架 MIL-101(Fe)复合,制备吸附剂 H 6 P 2 W 18 O 62 /
323 K 156.0062 7.97 2.08×10 0.9859 134.2119 4.8994 0.8827 MIL-101(Fe)。该复合物在酸性条件下电离出大量杂
–3
注:R L 为分离因子。R L 的计算公式为:R L=1/(1+K Lρ 0),其中, 多阴离子,通过静电作用对亚甲基蓝等阳离子染料
K L 为 Langmuir 等温吸附常数,L/g;ρ 0 为初始质量浓度,mg/L。
具有很强的吸附效果。在 303 K 下 H 6 P 2 W 18 O 62 /
热力学数据计算公式如下,根据实验数据计算 MIL-101(Fe)对 MB 的最大吸附量可达 148.1 mg/g。
热力学参数见表 4。 表征结果表明,H 6 P 2 W 18 O 62 以客体的形式存在于
Δ G=–RTlnK L (5) MIL-101(Fe)框架中,两者成功复合。实验结果表明,
l n ρ e =ΔH/(RT)+lnK L (6) 在 H 6 P 2 W 18 O 62 的负载量为 35%,溶液 pH=4 的条件
式中:R 为气体常数;T 为实验温度,K;K L 是 下吸附剂达到最佳效果。通过动力学和热力学研究,
Langmuir 等温吸附常数,L/g。 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附亚甲基蓝实验符合拟
表 4 H 6 P 2 W 18 O 62 /MIL-101(Fe)吸附 MB 的热力学参数 二级动力学模型和 Langmuir 等温吸附模型,并且是
Table 4 Thermodynamic parameters of MB adsorption on 一个自发吸热的物理吸附过程。该吸附剂将MIL-101(Fe)
H 6 P 2 W 18 O 62 /MIL-101(Fe)
的高孔隙率、巨大比表面积等特性与 H 6 P 2 W 18 O 62 的
T/K
独特配位能力、大量杂多阴离子的优良特性集于一
303 313 323
身,通过两者的协同作用提高材料稳定性,增强了
K L/(L/g) 269.64 14.85 7.97
吸附性能。理论上该吸附剂对于工业中带有正电荷
ΔG/(kJ/mol) –14.947 –7.443 –7.443
的污染物均有选择吸附性能,适用于工业生产。
ΔH/(kJ/mol) 132.012
ΔS/〔J/(mol·K)〕 451.9 (下转第 1929 页)