Page 94 - 《精细化工》2020年第6期
P. 94
·1160· 精细化工 FINE CHEMICALS 第 37 卷
TP
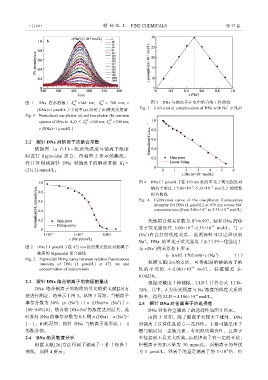
图 1 DNa 在水溶液〔 ex OP =348 nm; ex = 700 nm; c 图 3 DNa 与钠离子在水中络合的工作曲线
+
(DNa)=1 μmol/L〕中的单(a)-双光子(b)荧光发射谱 Fig. 3 Job's plot of complexation of DNa with Na in H 2 O
Fig. 1 Normalized one-photon (a) and two-photon (b) emission
OP
spectra of DNa in H 2 O ( ex =348 nm; ex TP =700 nm;
c (DNa)=1 μmol/L)
2.2 探针 DNa 对钠离子的络合常数
依据图 1a 在归一化荧光强度与钠离子浓度
间进行 Sigmoidal 拟合,得到图 2 所示的曲线。
经计算得到探针 DNa 对钠离子的解离常数 K d =
(23±2) mmol/L。
图 4 DNa(1 µmol/L)在 470 nm 处的单光子荧光强度对
–5
–4
钠离子浓度(5.00×10 ~5.33×10 mol/L)的线性
拟合曲线
Fig. 4 Calibration curve of the one-photon fluorescence
+
intensity for DNa (1 µmol/L) at 470 nm versus Na
–5
–4
concentrations (from 5.00×10 to 5.33×10 mol/L)
2
线性拟合相关系数为 R =0.997,表明 DNa 的单
–4
–5
光子荧光强度在 5.00×10 ~5.33×10 mol/L,与 c
+
(Na )有良好的线性关系,说明探针可以定量识别
+
Na 。DNa 的单光子荧光强度(I F )(归一化强度)
图 2 DNa(1 µmol/L)在 472 nm 处的荧光强度对钠离子 与 c(Na )的关系如下所示:
+
浓度的 Sigmoidal 拟合曲线 I F =0.985–1705.698×c (Na ) (1)
+
Fig. 2 Sigmoidal fitting curve between relative fluorescence
intensity of DNa (1 µmol/L) at 472 nm and 根据文献[26]的方法,可得配制溶液钠离子浓
–4
concentration of sodium ions 度的平均 值 A=2.003×10 mol/L,标 准偏差 S=
0.00238。
2.3 探针 DNa 络合钠离子的物质的量比 根据灵敏度(检测限,LLD)计算公式 LLD=
DNa 络合钠离子的物质的量比根据文献[25]方 3S/k,其中,k 为荧光强度与 Na 浓度的线性关系的
+
法进行测定,结果示于图 3。从图 3 可知,当钠离子 斜率,得到 LLD≈4.186×10 mol/L。
–6
+
+
摩尔分数为 50% {n (Na ) /〔n (DNa)+n (Na )〕× 2.5 探针 DNa 对金属离子的选择性
+
100=50%}时,络合物 DNa-Na 的浓度达到最大,此 DNa 对各种金属离子的选择性如图 5 所示。
+
时探针 DNa 的摩尔分数为 0.5,则 n (DNa)∶n (Na )= 由图 5 可知,除了锂离子有较大干扰外,DNa
1∶1。由此可知,探针 DNa 与钠离子是形成 1∶1 对钠离子具有优良的专一选择性。主要可能是由于
的配合物。 锂与钠属同一主族元素,有相似的鳌合性,且离子
2.4 DNa 的灵敏度分析 半径差别不是太大所致。虽然锂离子有一定的干扰,
根据文献[26]方法得到了钠离子工作(校准) 但锂离子的加入量为 30 mmol/L,而钠离子的量仅
4
曲线,如图 4 所示。 为 1 μmol/L,锂离子的量是钠离子的 3×10 倍,因