Page 94 - 《精细化工》2020年第7期
P. 94
·1376· 精细化工 FINE CHEMICALS 第 37 卷
子 BDP-NBD 的特征峰逐渐消失,而在 6.44 min 处
出现了一个来自前驱体Ⅲ的特征峰。这表明生物硫
醇的引入可以使探针分子的醚键断裂,从而释放出
具有强荧光发射的前驱体Ⅲ,这也和文献[23]中报
道的机理一致。
图 4 加入不同生物硫醇后 BDP-NBD 的高效液相色谱图
Fig. 4 HPLC spectra of probe BDP-NBD with addition of
different biothiols
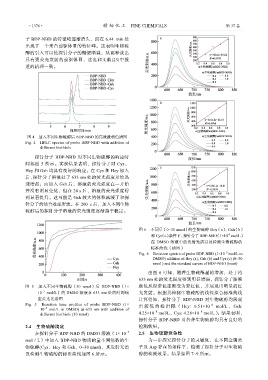
探针分子 BDP-NBD 对不同生物硫醇的响应时
间如图 5 所示。实验结果表明,探针分子对 Cys、
Hcy 和 Gsh 均具有良好的响应。在 Cys 和 Hcy 加入
后,探针分子溶液处于 633 nm 处的荧光强度开始迅
速增强;而加入 Gsh 后,溶液的荧光强度在一开始
并没有明显变化,但在 20 s 后,溶液的荧光强度得
到显著提升。这可能是 Gsh 较大的体积减缓了和探
针分子的结合效率所致。在 200 s 后,加入不同生物
硫醇后的探针分子溶液的荧光强度逐渐趋于稳定。
图 6 不同量(0~30 nmol)的生物硫醇 Hcy(a)、Gsh(b)
–5
和 Cys(c)条件下,探针分子 BDP-NBD(1×10 mol/L)
在 DMSO 溶液中的发射光谱以及检测生物硫醇的
标准曲线(插图)
–5
Fig. 6 Emission spectra of probe BDP-NBD (1×10 mol/L in
DMSO) addition of Hcy (a), Gsh (b) and Cys (c) (0~30
nmol ) and the standard curves of BDP-NBD (inset)
由图 6 可知,随着生物硫醇量的增加,处于约
633 nm 处的荧光强度得到明显增强,探针分子溶液
图 5 加入不同生物硫醇(30 nmol)后 BDP-NBD(1× 颜色从深紫色逐渐变为紫红色,并展现出明显的红
–5
10 mol/L)的 DMSO 溶液在 633 nm 处的时间响 光发射。根据其检测生物硫醇的线性拟合标准曲线
应荧光光谱图 计算得知,探针分子 BDP-NBD 对生物硫醇均展现
Fig. 5 Reaction time profiles of probe BDP-NBD (1× 出较低 的检 出限( Hcy: 6.51×10 mol/L , Gsh:
–8
–5
10 mol/L in DMSO) at 633 nm with addition of –8 –8
different biothiols (30 nmol) 4.25×10 mol/L,Cys: 4.28×10 mol/L)。结果表明,
探针分子 BDP-NBD 对各种生物硫醇均具有良好的
2.4 生物硫醇滴定 检测效果。
–5
在探针分子 BDP-NBD 的 DMSO 溶液(1× 10 2.5 生物硫醇竞争性
mol/L)中加入 BDP-NBD 物质的量不同倍数的生 为一步探究探针分子的灵敏度,在不同金属离
物硫醇(Cys、Hcy 和 Gsh,0~30 nmol),其发射光谱 子及 Asp 存在的条件下,检测了探针分子对生物硫
及检测生物硫醇的标准曲线如图 6 所示。 醇的检测效果。结果如图 7~9 所示。