Page 77 - 《精细化工》2022年第3期
P. 77
第 3 期 徐群娜,等: 抗菌黏附型酪蛋白基纳米复合水凝胶的制备 ·499·
中,在一定的时间间隔取出,用滤纸去除表面残留 所有的实验步骤遵循实验动物护理和使用指
的水分称重(W 2 ),直至保持恒重。其溶胀率按公 南:第 8 版,ISBN-10:0-309-15396-4,由西安交通
式(2)计算: 大学动物伦理委员会批准。
W W
SR/ % 2 1 100 (2)
W 1 2 结果与讨论
式中:SR 为水凝胶的溶胀率,%;W 1 为水凝胶干燥 2.1 酪蛋白/ZnO 纳米复合水凝胶的结构表征
时的质量,g;W 2 为水凝胶溶胀平衡时的质量,g。 采用“半溶解溶胶-凝胶酸化法”制备得到 ZnO
1.3.5 力学性能 NPs 添加量为 3%的酪蛋白/ZnO 纳米复合水凝胶的
1.3.5.1 动态流变性能 红外光谱如图 2 所示。
利用流变仪来测定样品的动态黏弹性。将水凝
胶样品置于流变仪的测定平台,静置 2 min 释放残
余的应力,调节好间距后,涂抹一层硅油防止水分
挥发。25 ℃下,测定不同的样品储能模量(G′)以
及损耗模量(G″)与频率的相关性,频率变化范围
为 0.1~100 Hz。
1.3.5.2 单轴拉伸性能
根据测试项目利用模具对水凝胶样品进行裁
剪,试样规格为哑铃形,全长 35 mm,其中有效长
为 15 mm,中间宽度为 2 mm。为保证样品的湿度均
衡,采用恒温恒湿箱内放置 12 h。然后采用测厚仪
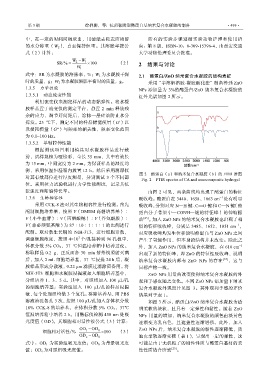
图 2 酪蛋白(a)和纳米复合水凝胶(b)的 FTIR 谱图
对其有效部位进行厚度测量,分别测试 3 个不同部
Fig. 2 FTIR spectra of CA and nanocomposite hydrogel
位。采用拉力试验机进行力学性能测试,记录其抗
张强度和断裂伸长率。 由图 2 可见,两条曲线均出现了酪蛋白的特征
1.3.6 生物相容性 吸收峰。酪蛋白在 3440、1658、1063 cm 处有明显
−1
采用 CCK-8 法对其生物相容性进行检测。首先 吸收峰,分别对应 N—H 键、C==O 键和 C—N 键(酪
配制细胞培养基,按照 V(DMEM 高糖培养基)∶ 蛋白分子骨架中—CONH—键的特征峰)的伸缩振
V(小牛血清)∶V(丙酮酸钠)∶V(谷氨酰胺)∶ 动 [23] 。加入 ZnO NPs 的纳米复合水凝胶也出现了相
V(非必须氨基酸)为 87∶10∶1∶1∶1 的比例进行 似的特征吸收峰,分别是 3485、1652、1051 cm ,
−1
配制。取对数生长期的 NIH-3T3,进行细胞计数, 对应吸收峰均发生位移说明酪蛋白与 ZnO NPs 之间
3
调整细胞浓度,按照 4×10 个/孔接种到 96 孔板中, 产生了氢键作用,但本身的结构并未改变。除此之
体积分数 5% CO 2 ,37 ℃恒温培养箱中培养过夜。 外,加入 ZnO NPs 的纳米复合水凝胶,在 610 cm −1
称取样品 0.2 g,正反面各 30 min 紫外线照射灭菌 出现了新的特征峰,即 ZnO 的特征性吸收峰,说明
后,加入 2 mL 细胞培养基,37 ℃浸提 24 h 后,凝 纳米复合水凝胶内部有 ZnO NPs 的存在 [24] ,这与
胶样品形成分散液,0.22 μm 滤膜过滤除菌备用。将 目标产物一致。
NIH-3T3 细胞和水凝胶浸提液加入细胞培养基中, ZnO NPs 用量的改变使得纳米复合水凝胶的外
分组培养 1、3、5 d。其中,对照组加入 100 μL/孔 观和手感也随之变化。不同 ZnO NPs 添加量下纳米
的细胞培养基;实验组加入 100 μL/孔的样品浸提 复合水凝胶外观照片见图 3。其外观和手感的评价
液,每个处理组均做 3 个复孔。移除培养基,用 PBS 结果列于表 1。
溶液清洗各孔 3 次,按照 100 μL/孔加入含体积分数 如图 3 所示,酪蛋白/ZnO 纳米复合水凝胶为透
10% CCK-8 的培养基,在体积分数 5% CO 2 ,37℃ 明柔软的块状,且具有一定弹性和黏性。随着 ZnO
恒温培养箱中培养 2 h。用酶标仪检测 450 nm 处吸 NPs 用量的增加,纳米复合水凝胶的颜色由淡黄色
光度值(OD)。其细胞相对活性按公式(3)计算: 逐渐变为乳白色,且遮盖性逐渐增强。此外,加入
OD OD ZnO NPs 后,纳米复合水凝胶的黏性逐渐降低,质
细胞相对活性/ %= 1 0 100 (3)
OD OD 0 地由柔软逐渐变硬(表 1),呈现出一定的弹性,这
c
式中:OD 1 为实验组吸光度值;OD 0 为背景吸光度 可能是由于无机粒子的刚性性质与酪蛋白基材的柔
值;OD c 为对照组吸光度值。 性性质结合所致 [25] 。