Page 79 - 《精细化工》2022年第3期
P. 79
第 3 期 徐群娜,等: 抗菌黏附型酪蛋白基纳米复合水凝胶的制备 ·501·
添加量相符,说明 ZnO NPs 在复合水凝胶中起到了 葡萄球菌与大肠杆菌均产生了抑制作用。此外,随
良好的交联点作用,有利于形成纳米复合水凝胶致 着 ZnO NPs 添加量的增多,抑菌圈逐渐扩大,纳米
密均匀的孔道结构,不仅可以赋予材料良好的吸水 复合水凝胶的抑菌作用也不断增强。
溶胀性能,也为其弹性和拉伸性能提供了可延伸的 在采用“半溶解溶胶-凝胶酸化法”制备该体系
空间 [27] 。 的过程中(图 1),ZnO NPs 分散液与酪蛋白溶解液
+
2.2 抗菌性能 均匀混合,酸溶液在温度作用下缓慢释放 H ,使得
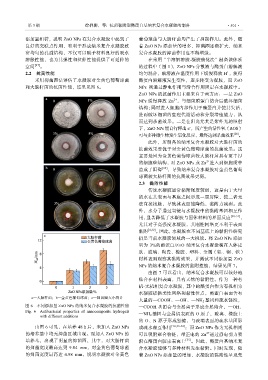
采用抑菌圈法评估了水凝胶对金黄色葡萄球菌 酪蛋白溶解液发生变性,逐步转变为凝胶,而 ZnO
和大肠杆菌的抗菌性能,结果见图 6。 NPs 则通过静电作用与缔合作用固定在水凝胶中。
ZnO NPs 的抗菌作用主要来自于两方面:一是 ZnO
2+
NPs 缓慢释放 Zn ,与细菌膜蛋白结合后破坏细菌
结构;同时进入细胞内部作用于酶蛋白并使其失活,
进而破坏细菌的生理代谢活动和分裂增殖能力,从
而达到杀菌效果。二是在阳光尤其是紫外光的照射
–
下,ZnO NPs 能自行释出 e ,所产生的活性氧(ROS)
[28]
可与多种微生物发生氧化反应,最终达到杀菌效果 。
此外,所制备的纳米复合水凝胶对大肠杆菌的
抗菌效果要优于对金黄色葡萄球菌的抗菌效果。这
主要是因为金黄色葡萄球菌较大肠杆菌具有更丰厚
2+
的细胞壁结构,对 ZnO NPs 或 Zn 进入到细胞质中
造成了阻碍 [29] ,导致纳米复合水凝胶对金黄色葡萄
球菌较大肠杆菌的抗菌效果更弱。
2.3 黏附性能
传统水凝胶通常黏附强度较弱,这是由于大量
的水在其表面与基底之间形成一层屏障,使二者无
法直接接触,导致其表面能降低,黏附力减弱。此
外,水分子通过氢键与水凝胶中的黏附基团相互作
用,显著降低了水凝胶与固体材料的界面反应 [30-31] ,
尤其对于高强度水凝胶,其刚性网络更不利于表面
黏附 [4,32] 。因此,水凝胶在不同基底上的黏附性研究
仍是当前水凝胶领域的一大挑战。将 ZnO NPs 添加
量为 3%的酪蛋白/ZnO 纳米复合水凝涂覆在人体皮
肤、玻璃、陶瓷、橡胶、塑料、金属(铝、钢、铁)
材料表面观察其黏附效果,并测试不同添加量 ZnO
NPs 的纳米复合水凝胶的黏附性能,结果见图 7。
由图 7 可以看出,纳米复合水凝胶可以较好地
贴合在材料表面,具有天然的黏附性。作为一种有
机-无机相复合水凝胶,其中的酪蛋白作为有机相为
水凝胶提供柔性网络和黏性位点,酪蛋白表面含有
a—大肠杆菌;b—金黄色葡萄球菌;c—抑菌圈大小统计 大量的—COOH、—OH、—NH 2 基团和疏水链段,
图 6 不同添加量 ZnO NPs 的纳米复合水凝胶的抗菌性能 —COOH 基团会与金属离子形成金属络合,—OH、
Fig. 6 Antibacterial properties of nanocomposite hydrogels —NH 2 基团与金属铝表面的 O 原子,玻璃、橡胶上
with different additions
的 O、N 原子形成氢键,与玻璃表面的疏水基团形
由图 6 可见,在培养 48 h 后,未加入 ZnO NPs 成疏水相互作用 [12,33-34] ;而 ZnO NPs 作为无机相则
2+
的培养基中均无抑菌区域出现。而加入 ZnO NPs 的 可以吸附聚合物链,带正电的 Zn 通过静电引力吸
培养基,出现了明显的抑菌圈,其中,对大肠杆菌 附在酪蛋白胶束表面上 [35] 。因此,酪蛋白基纳米复
的抑菌宽度最高达到 9.04 mm,对金黄色葡萄球菌 合水凝胶能够与多种材料发生黏附。同时发现,随
的抑菌宽度最高达 4.98 mm,说明水凝胶对金黄色 着 ZnO NPs 添加量的增加,水凝胶的黏附性呈现先