Page 113 - 201810
P. 113
第 10 期 林 壮,等: β-环糊精交联树脂的合成及其对双酚酸的吸附 ·1721·
为 β-CDP 的平衡吸附量,mg/g;K L 为 β-CDP 吸附 β-CDP 吸附 DPA 的吸附量与吸附率相差不大,分别
DPA 的 Langmuir 平衡常数,L/mg;K F 为 β-CDP 吸 为 66.2~68.0 mg/g 和 82.7%~85.0%;然而,当 pH≥
附 DPA 的 Freundlich 平衡常数,mg/g;n 为 Freundlich 4.3 时,吸附量与吸附率急剧下降。当 pH≤4.3 时,
模型参数。 DPA 在水溶液中主要以分子形式存在,容易通过氢
分别控制恒温水浴温度为 25、35、45 ℃,向 键作用与 β-CDP 结合,以及疏水作用进入 β-CDP 内
不同质量浓度的 DPA 溶液中加入 0.05 g β-CDP吸附 部空腔;随着 pH 增加,DPA 电离程度增大,DPA
剂,根据 Langmuir 和 Freundlich 模型公式,以等温 主要以离子形式存在,离子态的 DPA 不易被 β-CDP
条件下 β-CDP 吸附不同质量浓度 DPA 溶液的 ρ e 和 吸附,从而导致 β-CDP 的吸附性能下降。
q e 为基础,绘制 Langmuir 和 Freundlich 吸附等温线。
1.6 吸附热力学
吸附热力学方程 [15] 如下所示:
Δ 0 ΔS H 0
ln K D = - (6)
R RT
ΔH -
ΔG 0 =Δ 0 T S 0 (7)
式中:K D 是反应达到平衡时的分配常数,K D 由 q e /ρ e
求得,L/g;R=8.314 J/〔molK〕,为理想气体常数;
0
0
ΔS 为标准反应熵,J/〔molK〕;ΔG 为标准吉布斯
0
自由能,kJ/mol;ΔH 为标准反应焓,kJ/mol;T 为
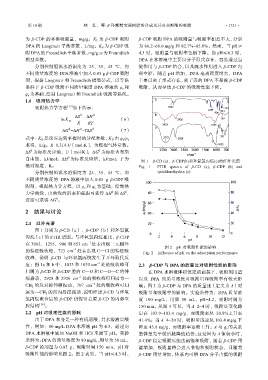
图 1 β-CD (a)、β-CDP(b)和环氧氯丙烷(c)的红外光谱
绝对温度,K。 Fig. 1 FTIR spectra of β-CD (a), β-CDP (b) and
分别控制恒温水浴温度为 25、35、45 ℃,向 epichlorohydrin (c)
不同质量浓度的 DPA 溶液中加入 0.05 g β-CDP 吸
附剂,根据热力学方程,以 ρ e 和 q e 为基础,绘制热
0
0
力学曲线,由曲线的斜率和截距可求得 ΔH 和 ΔS ,
0
进而可求得 ΔG 。
2 结果与讨论
2.1 红外光谱
图 1 分别为 β-CD(a)、β-CDP(b)和环氧氯
丙烷(c)的 FTIR 谱图。与环氧氯丙烷相比,β-CDP
1
在 3063,1255,906 和 853 cm 处未出现三元醚环
图 2 pH 对吸附性能的影响
1
的特征吸收峰,723 cm 处未出现 C—Cl 的特征吸 Fig. 2 Influence of pH on the adsorption performance
收峰,说明 β-CD 与环氧氯丙烷发生了开环取代反
1
应;图 1a 和 b 中,1033 和 1035 cm 处的吸收峰可 2.3 β-CDP 与 DPA 的质量比对吸附性能的影响
归属为 β-CD 和 β-CDP 腔内 C—O 和 C—O—C 的伸 在 DPA 水溶液体积恒定的前提下,吸附剂用量
1
缩振动,2928 和 2926 cm 处的吸收峰可归属为— 以及 DPA 的质量浓度对吸附量和吸附率有较大影
CH 2 的反对称伸缩振动,707 cm 1 处的吸收峰可归 响。图 3 为 β-CDP 与 DPA 的质量比(定义为 A)对
属为—CH 2 的面内摇摆振动,说明经过 β-CD 与环氧 吸附量和吸附率的影响。实验条件为:DPA 质量浓
氯丙烷聚合后的 β-CDP 仍保留着原 β-CD 的内部空 度 100 mg/L,用量 50 mL,pH=4.2,吸附时间为
腔结构 [16] 。 150 min。从图 3 可见,当 A=2~4 时,吸附量变化稳
2.2 pH 对吸附性能的影响 定在 103.9~103.4 mg/g,而吸附率从 20.8%上升至
由于 DPA 本身是一种有机弱酸,其水溶液呈酸 41.4%;当 A=4~20 时,吸附量迅速从 103.4 mg/g 下
性,例如:80 mg/L DPA 水溶液 pH 为 4.3,通过向 降至 43.8 mg/g,而吸附率逐渐上升。A 与 q e 的关系
DPA 水溶液中滴加 NaOH 和 HCl 来调节 pH。实验 整体呈先平缓后陡降的趋势。这是因为 A 值较小时,
条件为:DPA 的质量浓度为 80 mg/L,用量为 50 mL, β-CDP 稳定吸附后能达到饱和吸附,随着 β-CDP 用
β-CDP 的用量为 0.05 g,吸附时间 150 min,pH 对 量增加,吸附量将会进入非饱和吸附状态,且随着
吸附性能的影响见图 2。图 2 表明,当 pH≤4.3 时, β-CDP 用量增加,体系内可供 DPA 分子占据的吸附