Page 114 - 201810
P. 114
·1722· 精细化工 FINE CHEMICALS 第 35 卷
位点增加,使 β-CDP 的吸附率增加,但是单位质量
的 β-CDP 吸附 DPA 的总量下降,所以吸附量降低。
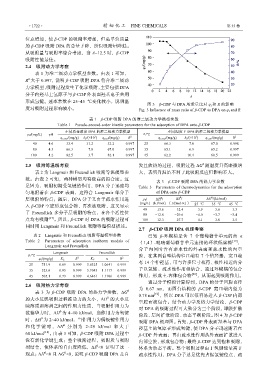
从吸附量与吸附率综合考虑,当 A=12.5 时,β-CDP
吸附性能最佳。
2.4 吸附动力学考察
表 1 为准二级动力学模型参数。由表 1 可知,
2
R 大于 0.997,说明 β-CDP 吸附 DPA 符合准二级动
力学模型,吸附过程发生了化学吸附,主要包括 DPA
分子内羟基上氢原子与 β-CDP 外表面羟基电子共用
形成氢键。速率常数在 25~45 ℃变化较小,说明温
图 3 β-CDP 与 DPA 的质量比对 q t 和 R 的影响
度对吸附过程影响较小。 Fig. 3 Influence of mass ratio of β-CDP to DPA on q t and R
表 1 β-CDP 吸附 DPA 的准二级动力学模型参数
Table 1 Pseudo-second-order kinetic parameters for the adsorption of DPA onto β-CDP
不同质量浓度 DPA 的准二级动力学模型 不同温度下 DPA 的准二级动力学模型
ρ 0/(mg/L) pH θ/℃
2
3
3
2
q e,exp/(mg/g) k 2/(×10 ) q e,cal/(mg/g) R q e,exp/(mg/g) k 2/(×10 ) q e,cal/(mg/g) R
40 4.6 33.4 31.2 32.2 0.997 25 66.3 7.8 67.0 0.998
80 4.3 66.3 7.8 67.0 0.997 35 65.1 6.9 65.2 0.997
100 4.2 82.5 3.7 82.1 0.997 45 62.2 10.4 60.5 0.999
0
2.5 吸附等温线考察 发且放热的过程,吸附过程 ΔG 随温度升高略微增
表 2 为 Langmuir 和 Freundlich 吸附等温模型参 大,表明升温虽不利于此吸附反应但影响不大。
数。由表 2 可知,两种模型均有极高的拟合度。这
表 3 β-CDP 吸附 DPA 的热力学参数
是因为,吸附初期受氢键的作用,DPA 分子迅速均 Table 3 Parameters of thermodynamics for the adsorption
匀地附着在 β-CDP 表面,这符合 Langmuir 单分子 of DPA onto β-CDP
0
0
0
层吸附的特点;随后,DPA 分子又由于疏水作用进 ρ 0/ ΔH / ΔS / ΔG /(kJ/mol)
(mg/L) (kJ/mol) 〔J/(molK)〕 25 ℃ 35 ℃ 45 ℃
入 β-CDP 空腔形成包合物,再次被吸附,这又显示
40 13.6 32.4 3.9 3.6 3.3
了 Freundlich 多分子层吸附的特点,在各个活性位 80 12.8 29.6 4.0 3.7 3.4
点均有吸附 [17] 。所以,β-CDP 对 DPA 的吸附过程可 100 12.3 27.7 4.1 3.8 3.5
同时用 Langmuir 和 Freundlich 吸附等温模型描述。
2.7 β-CDP 吸附 DPA 机理考察
表 2 Langmuir 和 Freundlich 吸附等温模型参数 已知 β-环糊精是含 7 个葡萄糖苷单元的由 α
Table 2 Parameters of adsorption isotherm modals of (1,4)-吡喃葡萄糖苷单元连接的环状低聚糖 [19] ,
Langmuir and Freundlich
分子内同时含有亲水性的外表面和疏水性的内空
Langmuir Freundlich
θ/℃ 腔,在其圆台型结构窄口端有 7 个伯羟基,宽口端
q 0/(mg/g) K L R 2 K F n R 2
有 14 个仲羟基,可与许多尺寸相符、极性相近的分
25 751.9 0.69 0.999 5.6325 1.0641 0.999
35 523.6 0.95 0.999 5.7045 1.1117 0.999 子以氢键、疏水性作用相结合,通过环糊精的包合
45 505.1 0.79 0.999 4.6461 1.1106 0.999 作用,形成主-客体包合物 [20] ,从而起到吸附作用。
通过分子模拟计算得到,DPA 的分子回旋直径
2.6 吸附热力学考察 为 0.67 nm,而圆台结构的 β-CDP 宽口端内径为
表 3 为 β-CDP 吸附 DPA 的热力学参数,ΔG 0 0.78 nm [10] ,所以 DPA 可以很容易进入 β-CDP 内部
0
的大小反映吸附过程推动力的大小,ΔH 的大小反
空腔而被包合。结合动力学及热力学结论,β-CDP
映溶质和溶剂之间的作用力性质,当吸附作用力为 对 DPA 的吸附过程可大致分为三个阶段,即膜扩散
0
范德华力时,ΔH 为 4~10 kJ/mol,当作用力为氢键 阶段、层间扩散阶段、动态平衡阶段。图 4 为 β-CDP
0
时,ΔH 为 2~40 kJ/mol,当作用力为偶极键作用力 吸附 DPA 机理图。首先,β-CDP 外表面羟基与 DPA
0
和化学 键时 , ΔH 分别 为 2~29 kJ/mol 和大 于 羟基上的氢原子形成氢键,使 DPA 分子迅速附着在
60 kJ/mol [18] 。由表 3 可知,β-CDP 吸附 DPA 过程中 β-CDP 外表面;再由疏水性作用从外表面扩散进入
没有新化学键生成;整个吸附过程,吸附质与吸附 内部空腔,形成包合物;最终 β-CDP 达到饱和吸附,
0
剂结合,使体系的自由度降低,ΔS <0 证明了这一 体系为动态平衡。整个吸附过程由于氢键能量高于
0
0
观点;ΔH <0 且 ΔG <0,说明 β-CDP 吸附 DPA 是自 疏水性作用,DPA 分子总是优先占据氢键位点,疏