Page 231 - 201904
P. 231
第 4 期 曾琼瑶,等: ZnS/AC 复合材料的制备及对铀酰离子的吸附性能 ·757·
2.8 热力学分析 Freundlich 方程 ln q ln K 1 ln (9)
热力学参数通过式(5)~(7)进行计算。 e F n e
q 式中:Q m 为吸附剂最大吸附量,mg/g;q e 为平衡时
K e (5)
d
e 吸附量,mg/g;ρ e 为平衡时铀酰离子质量浓度,mg/L;
H S K L 为 Langmuir 常数,L/mg;K F 、1/n 为表征吸附
ln K (6)
d
RT R 能力的常数。
G H T S (7) 图 14 和图 15 分别为 Langmuir 方程和 Freundlich
式中:K d 为吸附分配系数,L/mg;q e 为平衡时的吸 方程的拟合曲线,具体参数结果见表 4。由表 4 可
2
附量,mg/g;ρ e 为平衡时的质量浓度,mg/L;R 为 以得知,Langmuir 等温吸附方程的拟合程度(R =
常数,8.314 J/(mol K);T 为热力学温度,K;ΔH 0.97646)比 Freundlich 等温方程的拟合度(R =
2
为焓的变化,kJ/mol;ΔS 为熵的变化,J/(mol K); 0.69415)高,所以 ZnS/AC 对铀酰离子的吸附等温
ΔG 为吉布斯自由能,kJ/mol。 线符合 Langmuir 等温模型。
用 lnK d 对 1/T 作图,拟合得到直线,结果示于
图 13。其斜率和截距分别为 ΔH/R 和 ΔS/R,得到各
热力学参数,结果列于表 3。由表 3 可知,ZnS/AC
对铀酰离子吸附的 ΔH 为正值,表明该吸附是吸热
过程;ΔS 为正值,表明该过程自由度增加,吸附过
程中固液相界面混乱度增大,可能是由于铀酰离子
吸附于 ZnS/AC 表面形成稳定的络合物引起的。表 3
中 3 个不同温度下,吉布斯自由能全部小于 0,说
明 ZnS/AC 对铀酰离子的吸附过程是自发进行的,
且随着吸附温度的上升,ΔG 的绝对值变大,ZnS/AC
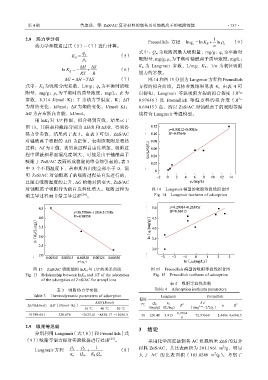
对铀酰离子吸附行为的自发程度增大。吸附过程为 图 14 Langmuir 模型的吸附等温线拟合图
熵主导过程而非焓主导过程 [24] 。 Fig. 14 Langmuir isotherm of adsorption
图 13 ZnS/AC 吸附铀的 lnK d 与 1/T 的关系曲线 图 15 Freundlich 模型的吸附等温线拟合图
Fig. 13 Relationship between lnK d and 1/T of the adsorption Fig. 15 Freundlich isotherm of adsorption
of the adsorption of ZnS/AC for uranyl ions
表 4 吸附等温线参数
表 3 吸附热力学参数 Table 4 Adsorption isotherm parameters
Table 3 Thermodynamic parameters of adsorption Langmuir Freundlich
温度
ΔG/(kJ/mol) Q m K L K F/
ΔH/(kJ/mol) ΔS/〔J/(mol K)〕 /℃ R 2 1n n n R 2
30 ℃ 40 ℃ 50 ℃ /(mg/g) /(L/mg) 〔(mg L )/g〕
91589.661 320.676 5623.41 8830.17 12036.9 50 120.48 3.915 0.9764 72.97668 1.4406 0.69415
6
2.9 吸附等温线 3 结论
分别利用 Langmuir〔式(8)〕和 Freundlich〔式
(9)〕吸附等温方程对实验数据进行处理 [25] 。 采用化学沉淀法制备 AC 负载纳米 ZnS 的复合
1 材料 ZnS/AC,其比表面积为 201.1961 m /g,明显
2
Langmuir 方程 e e (8)
q e Q m K Q m 大于 AC 的比表面积(165.0240 m /g)。考察了
2
L