Page 241 - 201905
P. 241
第 5 期 董秋辰,等: 一种新型联吡啶双子季铵盐的合成及缓蚀性能 ·1009·
结果。由表 3 可知,在不同温度下,吸附平衡常数 在不同温度下,E a 可通过图 7 中 lnr corr 和 1/T
K ads 均处于较高数值,表明 PBA 在 Q235 钢表面吸 的拟合获得。由式(9)可知,高的活化能(E a )会
附牢固,且高温下也有良好的缓蚀性能。吸附自由 使腐蚀速率降低。经计算发现,在不同温度下,添
0
能 ΔG ads为负值,表明 PBA 在 Q235 钢表面的吸附是 加不同质量浓度 PBA 的 E a (≥45 kJ/mol)均大于空
0
自发的。通常,当 ΔG ads大于20 kJ/mol 时,属于带 白盐酸中的 E a (36.6 kJ/mol)。故从动力学角度分析,
电分子和带电金属之间的静电相互作用(物理吸 PBA 的缓蚀性能主要归因于活化能的增加。通常,
0
附);当 ΔG ads小于40 kJ/mol 时,属于电荷共享或缓 物理吸附的活化能一般在 5~40 kJ/mol,而化学吸附
[18]
蚀剂分子转移到金属表面形成共价键(化学吸附) 。 在 40~800 kJ/mol [20] ,因此,PBA 在 Q235 钢表面是
0
故表 3 中的 ΔG ads表明,PBA 的吸附行为是以化学吸 化学吸附。
附为主的混合型吸附。
0
吸附热 ΔH ads可使用 Van't Hoff 公式〔公式(7)〕
计算:
ln K H 0 / RT X (7)
ads ads
0 0
式中:ΔH ads为吸附热,kJ/mol;X 为积分常数。ΔH ads
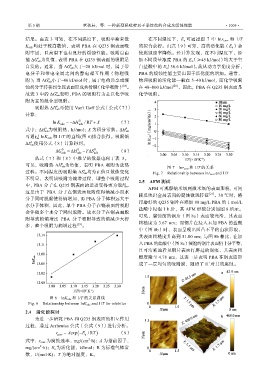
可通过 lnK ads 和 1/T 的直线(图 6)拟合获得。吸附熵
ΔS ads使用公式(8)计算得到。
0
G 0 H 0 T S 0 (8)
ads ads ads
从式(7)和(8)中推导的数据也列于表 3。
可见,吸附热 ΔH ads为负值,表明 PBA 吸附为放热
0
图 7 lnr corr 和 1/T 的关系
0
过程。不同温度的吸附熵 ΔS ads均为正值且数值变化 Fig. 7 Relationship between lnr corr and 1/T
不明显,表明该吸附为熵增过程,即整个吸附过程
2.5 AFM 测试
中,PBA 分子在 Q235 钢表面的运动变得更为混乱。
AFM 可观察纳米级到微米级的表面形貌,可间
这是由于 PBA 分子在钢表面吸附使得熵减小而水
接反映出金属表面的腐蚀微观特征 [21] 。30 ℃时,将
分子同时脱附使得熵增加,而 PBA 分子体积远大于
打磨好的 Q235 钢片在添加 80 mg/L PBA 的 1 mol/L
水分子体积,因此,单个 PBA 分子在钢表面的吸附
盐酸中浸泡 1 h 后,其 AFM 形貌分别如图 8 所示。
会伴随多个水分子同时脱附。故水分子在钢表面脱
可见,腐蚀前的钢片(图 8a)表面较光滑,其表面
附导致的熵增比 PBA 分子吸附导致的熵减少大得
多,整个吸附为熵增过程 [19] 。 粗糙度为 3.67 nm;而钢片在浸入未加 PBA 的盐酸
中(图 8b)时,表面呈现出凹凸不平的山状形貌,
其表面粗糙度升高到 51.00 nm;与图 8b 相比,在加
入 PBA 的盐酸中(图 8c)浸泡的钢片表面仍十分平整,
且可清晰地看见钢片表面打磨过的划痕,其表面粗
糙度降至 4.78 nm,这进一步表明 PBA 在钢表面形
+
成了一层均匀的吸附膜,阻碍了 H 对其的腐蚀。
图 6 lnK ads 和 1/T 的关系曲线
Fig. 6 Relationship between lnK ads and 1/T for inhibitor
2.4 活化能探讨
为进一步研究 PBA 和 Q235 钢表面的相互作用
过程,通过 Arrhenius 公式〔公式(9)〕进行分析。
A exp r / RT E (9)
corr a
2
式中:r corr 为腐蚀速率,mg/(cm ·h);A 为指前因子,
2
mg/(cm ·h);E a 为活化能,kJ/mol;R 为标准气体常
数,J/(mol·K);T 为绝对温度,K。