Page 107 - 《精细化工》2021年第12期
P. 107
第 12 期 郝中乾,等: 负载活性组分的核壳结构纤维膜的制备及性能 ·2469·
含量为 5%时,水接触角为 79.4°;当 Ss 含量为 20% 暴露于水中,加速 PVA 降解,同时释放 PAE。PCL
时,水接触角为 32.7°。有研究表明,水接触角在 在水中稳定不易降解,当壳层中 PEO 降解完全后,
30°~60°之间有利于细胞的增殖黏附 [11] 。 会在一定程度上阻碍水分和核层的接触,从而减慢
了核层 PVA 降解,PAE 的释放减缓。核壳结构实现
表 1 纳米纤维膜的力学性能和水接触角 了药物的长效释放,7 d 内药物累积释放率可达到
Table 1 Mechanical properties and water contact angles of
nanofiber membranes 77%。
样品 杨氏模量/MPa 拉伸强度/MPa 水接触角/(°)
PP@PAE 36.51.2 2.80.08 93.8
PPS@PAE-1 40.51.6 2.90.07 79.4
PPS@PAE-2 43.01.2 3.10.07 66.2
PPS@PAE-3 47.91.9 3.90.09 56.4
PPS@PAE-4 50.81.9 4.30.08 32.7
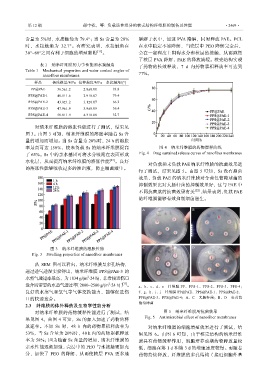
对纳米纤维膜的溶胀性能进行了测试,结果见
图 3。由图 3 可知,纳米纤维膜的溶胀率随着 Ss 含
量的增加而增加。当 Ss 含量为 20%时,24 h 的溶胀
率最高可达 150%,较未负载 Ss 的纳米纤维膜提高 图 4 纳米纤维膜的药物缓释曲线
了 65%。Ss 中的亲水基团可将水分吸附在表面形成 Fig. 4 Drug sustained release curves of nanofiber membranes
水化层,从而提高纳米纤维膜的溶胀性能 [25] 。良好
对负载和未负载 PAE 纳米纤维膜的抗菌效果进
的溶胀性能够吸收过多的渗出液,防止细菌滋生。 行了测试,结果见图 5。由图 5 可知,Ss 没有抑菌
效果,负载 PAE 的纳米纤维膜对金黄色葡萄球菌的
抑制效果比对大肠杆菌的抑制效果好,这与 PAE 中
不同抗菌肽的抗菌效果有关 [22] ,结果表明,负载 PAE
的纤维膜能够有效抑制细菌滋生。
图 3 纳米纤维膜的溶胀性能
Fig. 3 Swelling properties of nanofiber membranes
从 SEM 图可以看出,纳米纤维膜呈多孔结构,
通过透气透湿实验得出,纳米纤维膜 PPS@PAE-3 的
2
水蒸气透过率最高,为 1834 g/(m ·24 h),非常接近伤口
2
[11]
愈合所需要的水蒸气透过率〔2000~2500 g/(m ·24 h)〕 。 a、b、c、d、e—纤维膜 PP、PPS-1、PPS-2、PPS-3、PPS-4;
良好的水蒸气和氧气等气体交换能力,能够促进伤 f、g、h、i、j—纤维膜 PP@PAE、PPS@PAE-1、PPS@PAE-2、
口的快速愈合。 PPS@PAE-3、PPS@PAE-4;A、C—大肠杆菌;B、D—金黄色
葡萄球菌
2.3 纤维膜的体外释药及生物学性能分析
对纳米纤维膜的药物缓释性能进行了测试,结 图 5 纳米纤维膜的抗菌效果
果见图 4。由图 4 可知,Ss 的加入加速了药物的释 Fig. 5 Antimicrobial effect of nanofiber membranes
放速率。不加 Ss 时,48 h 内的药物累积释放率为 对纳米纤维膜的细胞增殖效果进行了测试,结
53%,当 Ss 含量为 20%时,48 h 内的药物累积释放 果见图 6。由图 6 可知,由于核壳结构的纳米纤维
率为 58%;因为随着 Ss 含量的增加,纳米纤维膜的 膜具有药物缓释作用,细胞培养前期药物释放量较
亲水性能逐渐加强,壳层中的 PEO 与水接触更加充 低,细胞在第 1 d 和第 3 d 的增殖速度较慢。而随着
分,加快了 PEO 的降解,从而使核层 PVA 更多地 药物持续释放,纤维膜的多孔结构(接近细胞外基