Page 97 - 《精细化工》2020年第2期
P. 97
第 2 期 马天怡,等: 碱性氨基酸改造食品蛋白质功能性研究进展 ·299·
天然肌球蛋白单体(Ⅰ/Ⅰ)经历蛋白中间体活 4.1.2 蛋白质其他水化能力
化态(Ⅱ/Ⅱ)形成蛋白中间体(Ⅲ/Ⅲ);这些中间 蛋白质的水化能力实质上是蛋白质与水的相互
体再次经历缔合大分子活化态(Ⅳ/Ⅳ)后,形成蛋 作用能力,而蛋白质与水的相互作用则关系到蛋白
白聚集体(Ⅴ)或抑制肌球蛋白聚集(Ⅴ)。在未 质的其他功能性,如分散性、溶解性、溶胀性、增
加入 Arg 的肌球蛋白体系中(图 4b),处于单体状 稠性、持水性、乳化性、凝胶性等。关于蛋白质水
态的天然肌球蛋白(Ⅰ)发生部分结构展开(Ⅱ) 化可分为:由表面张力引起的水合作用、由体积排阻
形成蛋白中间体(Ⅲ),而这些中间体不断相互靠近 引起的水合作用以及由水结合引起的水合作用 [39] 。以
形成Ⅳ后发生聚集致使蛋白细丝形成Ⅴ。 Arg 作为添加剂为例,先不考虑它在水中与蛋白质表
然而,在加入 Arg 的肌球蛋白体系中(图 4c), 面的弱相互作用,简单解释上述 3 种水化模式。
Arg 首先发生自缔合形成二聚体,随后与处于单体 理论上,Arg、NaCl 均能增加水的表面张力,
状态的肌球蛋白结合形成Ⅰ,致使蛋白-Arg 复合物 与蛋白质表面会发生不利的相互作用,所以 Arg 与
发生部分展开(活化态Ⅱ)而形成复合物中间体Ⅲ, NaCl 都会趋于远离蛋白质表面,尽可能发生溶剂
这些中间体相互靠近,形成更大的缔合物,“间隙效 化,即形成水合离子(图 5a)。由于 Arg 分子半径
应”导致 Arg 二聚体从孔隙被排阻,体系自由能增 大于水分子,所以 Arg 会被排阻在最外层,水分子
[60]
加,导致形成的小聚集体活化能提高,从而抑制了 也具有一定的体积,也会被排阻在蛋白质表面 (图
肌球蛋白聚集体(蛋白细丝)的形成。 5b)。
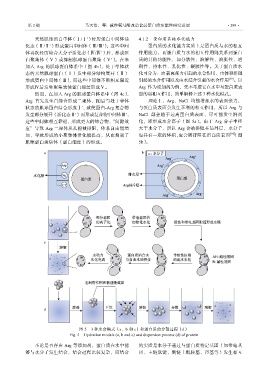
图 5 3 种水合模式(a、b 和 c)和蛋白质的分散过程(d)
Fig. 5 Hydration models (a, b and c) and dispersion process (d) of protein
不论是否存在 Arg 等添加剂,蛋白质在水中能 的实质是水分子通过与蛋白质特定基团(如带电基
够与水分子发生结合,结合过程比较复杂,而结合 团、主链肽键、侧链上酰胺基、羟基等)发生相互