Page 121 - 《精细化工》2021年第3期
P. 121
第 3 期 姚 周,等: 聚氨酯-Ch 水凝胶的制备及其作为伤口敷料的性能 ·541·
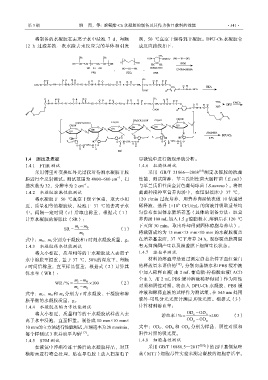
将制备的水凝胶在去离子水中浸泡 7 d,每隔 剂,50 ℃真空干燥得到干凝胶。DPU-Ch 水凝胶合
12 h 过滤并换一次水除去未反应完的单体和引发 成反应路线如下:
1.4 测试及表征 显微镜中进行微观形貌分析。
1.4.1 FTIR 测试 1.4.6 抗菌性测试
采用傅里叶变换红外光谱仪对待测水凝胶干胶 采用 GB/T 21866—2008 [18] 测定水凝胶的抗菌
–1
膜进行全反射测试。测试范围为 4000~600 cm ,扫 性能,测试菌种:革兰氏阴性菌大肠杆菌(E.coil)
–1
描次数为 32,分辨率为 2 cm 。 与革兰氏阳性菌金黄色葡萄球菌(S.aureus)。将细
1.4.2 水凝胶溶胀性能测试 菌菌种接种至营养肉汤中,在恒温摇床中 37 ℃,
将水凝胶于 50 ℃真空干燥至恒重,取大小相 120 r/min 过夜培养,用营养肉汤依次做 10 倍递增
6
近,质量相等的凝胶块,浸泡于 37 ℃的去离子水 稀释液,选择 1×10 CFU/mL 的菌液并吸取适量均
中。间隔一定时间(t)后取出称重,根据式(1) 匀涂布在固体琼脂培养基(具体的制备方法:取营
计算水凝胶的溶胀比(SR): 养肉汤 100 mL 加入 1.5 g 琼脂粉末,溶解后在 120 ℃
m m 下灭菌 30 min,取出冷却得到固体琼脂培养基),
SR t 0 (1)
m 0 将裁剪成约为 15 mm×15 mm×10 mm 的水凝胶覆盖
式中:m 0、m t 分别为干凝胶和 t 时刻水凝胶质量,g。 在培养基表面,37 ℃下培养 24 h,观察覆盖膜周围
1.4.3 水凝胶保水性能测试 有无抑菌圈产生以及覆盖膜下细菌生长状态。
将大小相近,质量相等的干水凝胶放入去离子 1.4.7 溶血率测试
水中溶胀至恒重,置于 37 ℃,50%的湿度下,每隔 材料的溶血率是通过测定静态条件下血红蛋白
t 时间后称重,直至样品恒重,根据式(2)计算其 的释放量来评价的 [19] 。分别向蒸馏水和 PBS 缓冲液
保水率(WR): 中加入稀释血液〔由 2 mL 葡萄糖-柠檬酸血液(ACD
m m 全血),用 2 mL PBS 缓冲溶液稀释得到〕作为阳性
WR / % t 0 100 (2)
m m 0 对照和阴性对照。将加入 DPU-Ch 水凝胶、PBS 缓
e
式中:m t 、m 0 和 m e 分别为 t 时水凝胶、干凝胶和溶 冲液和稀释血液的试样作为测试组,在 545 nm 处用
胀平衡的水凝胶质量,g。 紫外-可见分光光度计测定其吸光度。根据式(3)
1.4.4 水凝胶压缩力学性能测试 计算材料溶血率:
将大小相近,质量相等的干水凝胶试样放入去 /% 溶血率 OD OD n 100 (3)
s
离子水中浸泡,直至恒重。制备成 10 mm×10 mm× OD OD n
p
10 mm的立方块进行性能测试,压缩速率为20 mm/min, 式中:OD s 、OD n 和 OD p 分别为样品、阴性对照和
每个样测试 3 次并取平均值 [17] 。 阳性对照的吸光度。
1.4.5 SEM 测试 1.4.8 细胞毒性测试
在液氮中淬断冷冻干燥后的水凝胶样品,对其 采用 GB/T 16886.5—2017 [20] 中的四甲基偶氮唑
横断面进行喷金处理,贴在导电胶上放入扫描电子 蓝(MTT)细胞毒性实验来测定凝胶的细胞存活率。