Page 194 - 《精细化工》2022年第1期
P. 194
·184· 精细化工 FINE CHEMICALS 第 39 卷
对 Cr(Ⅵ)的等温吸附过程,然而 SBEC、SBE 的 强。ΔG 为负值且随着温度的增加减小,表明吸附过
Langmuir、Freundlich 两种吸附等温模型拟合的相关 程是一个自发过程且温度升高吸附越容易进行。ΔS
系数均大于 0.9,且相差较小,Freundlich 等温线模 为正值表明吸附过程的无序性增加 [23] 。
型 n>2,这表明 SBEC、SBE 对 Cr(Ⅵ)吸附过程是比 q
K e (7)
较容易发生的,Cr(Ⅵ)在 SBEC、SBE 既发生了单分 d e
子层吸附又发生了具有物理和化学吸附较为复杂的 H S
ln K (8)
多分子层吸附。温度越高,SBEC、SBE 吸附效果越 d RT R
好,说明吸附过程是吸热过程 [22] 。 G RlnT K d (9)
热力学参数可用来判断 SBEC、SBE 对 Cr(Ⅵ) G H T S (10)
的吸附过程中热量的变化情况。热力学参数如吉布 式中:ΔG 为吸附吉布斯自由能变,kJ/mol;ΔH 为
斯自由能(ΔG)、焓变(ΔH)、熵变(ΔS)由公式 吸附焓变,kJ/mol;T 为绝对温度,K;ΔS 为吸附熵
(7~10)计算,结果见表 5。ΔH 是正值,说明 SBEC、 变, kJ/(mol·K);R 为理想气体常数,8.314 J/(mol·K);
SBE 对 Cr(Ⅵ)的吸附过程是吸热过程,与图 9 结论 K d 是分配系数;q e 为溶液达到吸附平衡时吸附剂吸
一致。温度升高分子运动加快, Cr(Ⅵ)与 SBEC、SBE 附的平衡吸附量,mg/g;ρ e 为吸附平衡时溶液中
的势能垒降低,SBEC、SBE 对 Cr(Ⅵ)的吸附能力增 Cr(Ⅵ)的质量浓度,g/L。
表 5 Cr(Ⅵ)在 SBEC、SBE 上的吸附热力学参数
Table 5 Thermodynamic parameters for the adsorption of Cr(Ⅵ) on SBEC and SBE
吸附剂 温度/K 拟合方程 ∆G/(kJ/mol) ∆H/(kJ/mol) ∆S/[kJ/(mol·K)]
SBEC 298 lnK d=–4.226/T+0.015 –3.555 35.781 0.132
308 –4.875 35.781 0.132
318 –6.195 35.781 0.132
SBE 298 lnK d=–3.926/T+0.016 –4.092 32.562 0.124
308 –5.322 32.562 0.124
318 –6.552 32.562 0.124
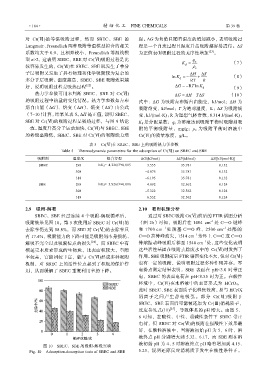
2.9 吸附-解吸 2.10 吸附机理分析
SBEC、SBE 经过连续 4 个吸附-解吸循环后, 通过对 SBEC 吸附 Cr(Ⅵ)前后的 FTIR 谱图分析
–1
吸附效果见图 10。第 5 次使用后 SBEC 对 Cr(Ⅵ)的 (图 2b)可知,吸附后在 1404 cm 处 C—O 键峰
去除率仍达到 58.8%,而 SBE 对 Cr(Ⅵ)的去除率只 和 1700 cm −1 处羧基 C==O 峰、2500 cm –1 处醛的
–1
有 17.4%,吸附能力的下降可能是吸附剂本身损耗、 C==O 拉伸峰消失,1514 cm 芳环上 C==C 或 C==O
–1
解吸不完全以及吸附位点的损失 [24] 。而 SBEC 中有 伸缩振动峰吸附后移至 1540 cm 处,这些变化表明
榴莲壳木质素形成的生物炭,比表面积较大,空隙 这些活性基团在吸附去除废水中的 Cr(Ⅵ)时发挥了
率较高,官能团较丰富,能与 Cr(Ⅵ)形成多种吸附 作用。 SBE 吸附前后 FTIR 谱图变化不大,但对 Cr(Ⅵ)
机制,对 SBEC 上的活性位点起到了积极的保护作 也有一定的吸附,说明吸附过程多种作用并存。零
用,从而缓解了 SBEC 重复利用率的下降。 电势点测定结果表明,SBE 表面在 pH<3.0 时带正
电,SBEC 的表面电荷在 pH<8.55 时为正。在酸性
–
环境中,Cr(Ⅵ)在水溶液中的主要形式为 HCrO 4 ,
–
此时 SBEC、SBE 表面质子化程度较高,易与 HCrO 4
阴离子之间产生静电吸引。部分 Cr(Ⅵ)吸附于
SBEC、SBE 表面后可能被还原为 Cr(Ⅲ)消耗质子,
反应参见式(11) [25] ,导致体系的 pH 增大。由图 5、
6 可知,在酸性、中性、弱碱性条件下 SBEC 带正
电荷,但 SBEC 对 Cr(Ⅵ)的吸附在强酸性下效果最
好,在酸性溶液中,当溶液初始 pH 为 5、6 时,溶
液终点 pH 分别增大到 5.32、6.17,而 SBE 则在溶
液初始 pH 为 4、5 时溶液终点 pH 略有增加到 4.15、
图 10 SBEC、SBE 的吸附-解吸实验
Fig. 10 Adsorption-desorption tests of SBEC and SBE 5.23,说明还原反应消耗质子发生在酸性条件下。