Page 62 - 《精细化工》2022年第6期
P. 62
·1128· 精细化工 FINE CHEMICALS 第 39 卷
2.3 磁性分析 2.5 动力学吸附实验
用磁性测试系统测定 ZVIBC 和吸附 Cd(Ⅱ)后 应用 Pseudo-first-order 模型〔式 ( 3 )〕、
的 ZVIBC-Cd(Ⅱ)的磁化曲线如图 3 所示。可以看出, Pseudo-second-order 模型〔式(4)〕拟合 ZVIBC 对Cd(Ⅱ)
两种材料的矫顽力和剩磁值均较小,是典型的超顺 的动态吸附数据,结果见表 1,拟合公式如下 [32] :
磁材料 [30] ,其饱和磁化强度分别为 80.2、33.8 emu/g。 q q (1 e 1 kt ) (3)
t e
ZVIBC-Cd(Ⅱ)仍具有较高的磁化强度,吸附完成后 kqt
2
可以用磁铁吸附分离。 q 1 kq t 2e (4)
t
2e
式中:q t 为 t 时刻吸附量,mg/g;q e 为平衡时吸附
–1
量,mg/g;k 1 为一阶速率常数,min ;k 2 为二阶速
率常数,g/(mg·min);t 为时间,min。
图 5 为 ZVIBC 对 Cd(Ⅱ)吸附量随时间的变化曲
线,拟合参数如表 1 所示。
图 3 ZVIBC 和 ZVIBC-Cd(Ⅱ)的磁化曲线
Fig. 3 Magnetization curves of ZVIBC and ZVIBC-Cd(Ⅱ)
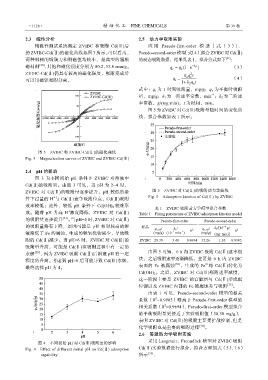
2.4 pH 的影响
图 3 为不同初始 pH 条件下 ZVIBC 对溶液中
Cd(Ⅱ)的吸附量。由图 3 可见,当 pH 为 2~4 时,
ZVIBC 对 Cd(Ⅱ)的吸附量逐步提升。pH 较低的条 图 5 ZVIBC 对 Cd(Ⅱ)的吸附动力学曲线
+
件下过量的 H 与 Cd(Ⅱ)竞争吸附位点,Cd(Ⅱ)吸附 Fig. 5 Adsorption kinetics of Cd(Ⅱ) by ZVIBC
效率较低;此外,较低 pH 条件下 Cd(OH) 2 较难形 表 1 ZVIBC 吸附动力学模型拟合参数
+
成。随着 pH 升高 H 浓度降低,ZVIBC 对 Cd(Ⅱ) Table 1 Fitting parameters of ZVIBC adsorption kinetics model
的吸附量逐步提升 [31] 。当 pH=5 时,ZVIBC 对 Cd(Ⅱ) Pseudo-first-order Pseudo-second-order
的吸附量略有下降,原因可能是 pH 相对较高的溶 样品 q e,cal/ k 1/ q e,cal/ k 2/[10 g/
–4
2
–1
–3
液降低了 Fe 的腐蚀,生成的铁氧化物减少,导致吸 (mg/g) (10 min ) R (mg/g) (mg·min)] R 2
附的 Cd(Ⅱ)减少。当 pH=6 时,ZVIBC 对 Cd(Ⅱ)的 ZVIBC 29.39 3.48 0.9694 35.26 1.10 0.9905
吸附量升高,可能是 Cd(Ⅱ)在吸附过程中有一定的
水解 [30] ,因为 ZVIBC 吸附 Cd(Ⅱ)后溶液 pH 有一定 由图 5 可知,6 h 内 ZVIBC 吸附 Cd(Ⅱ)速率很
快,之后吸附速率逐渐降低。主要是 6 h 内 ZVIBC
程度的升高。考虑到 pH>6 后可能导致 Cd(Ⅱ)水解,
2+
最终选择 pH 为 4。 表面的 Fe 被腐蚀 [33] ,生成的 Fe 将 Cd(Ⅱ)转化为
Cd(OH) 2 。之后,ZVIBC 对 Cd(Ⅱ)吸附速率减慢,
这一阶段主要是 ZVIBC 的官能团与 Cd(Ⅱ)形成配
位键以及 ZVIBC 内部的 Fe 被腐蚀参与吸附 [33] 。
由表 1 可见,Pseudo-second-order 模型的相关
2
系数(R =0.9905)略高于 Pseudo-first-order 模型的
2
相关系数(R =0.9694),Pseudo-first-order 模型拟合
的平衡吸附量更接近于实验吸附值(30.30 mg/g),
表明 ZVIBC 对 Cd(Ⅱ)的吸附主要受扩散控制,但是
化学吸附也是重要的吸附过程 [34] 。
2.6 等温热力学吸附实验
采用 Langmuir、Frenudlich 模型对 ZVIBC 吸附
图 4 不同初始 pH 对 Cd(Ⅱ)吸附量的影响
Fig. 4 Effect of different initial pH on Cd(Ⅱ) adsorption Cd(Ⅱ)实验数据进行拟合,拟合方程如式(5)、(6)
capability 所示 [35] :