Page 119 - 《精细化工》2023年第1期
P. 119
第 1 期 李 锋,等: 乳酸类低共熔溶剂分离油茶果壳木质素及其特性分析 ·111·
在固液比为 1∶20(g∶mL,下同)(其中,油茶果壳 Al 2 O 3 坩埚中,在氮气氛围下(流速为 20 mL/min),
粉末质量为 5 g)、提取时间为 5 h 条件下,考察不 以 10 ℃/min 的升温速度从室温加热至 800 ℃,热
同温度(100、120 和 150 ℃)对木质素提取率的影 裂解产生的挥发分通过气体输送管进入 FTIR 进行
–1
–1
响;此外,在固液比为 1∶20(其中,油茶果壳粉 光谱扫描,波数范围:4000~500 cm ,分辨率 4 cm ,
末质量为 5 g)、温度为 120 ℃的条件下,考察不同 采集数据信息后进行谱库检索。
提取时间(3、5、8 和 12 h)对木质素提取率的影 1.4 木质素抗氧化活性测定
响。以上反应结束后,加入 20 mL 无水乙醇终止反 称取一定质量木质素溶于 1,4-二氧六环溶液
应,用温度为 4 ℃的冰水浴冷却后,离心得到透明 〔V(1,4-二氧六环)∶V(去离子水)=9∶1〕,中,制得
液体,残渣用无水乙醇洗涤 3~5 次,合并过滤液体, 质量浓度为 0.2~1.0 g/L 的木质素溶液,取 0.1 mL 的
减压蒸除无水乙醇,将浓缩液缓慢加入 4 L 去离子 木质素溶液置于 10 mL 棕色离心管中,加入 3.9 mL
水中,随后过滤收集析出固体沉淀,用无水乙醇多 DPPH 的乙醇溶液(质量浓度为 25 mg/L),摇匀后,
次洗涤析出木质素,确保无 DES 残留,得到 DES 放置于 25 ℃的水浴摇床中,静置 30 min 后,利用
提取木质素,将其置于–52 ℃冷冻干燥机中干燥 24 h, 双光束紫外-可见分光光度计在波长 517 nm 处测量
分别记为 Bet/LA 和 TEBAC/LA 木质素(图中分别 溶液吸光度。DPPH 自由基清除率用式(2)计算:
以 Bet/LA 和 TEBAC/LA 标记)。以上粗木质素参照 A A
DPPH自由基清除率 / % = 0 i 100 (2)
文献[12]的方法进一步纯化,得到纯化木质素。 A 0
1.2.3 油茶果壳木质素含量和提取率测定 式中:A 0 为空白实验组吸光度;A i 为待测样品吸光度。
采用美国可再生能源实验室标准方法测定油茶
果壳木质素含量 [13] ,经测定油茶果壳中木质素质量 2 结果与讨论
分数为 33.27%。两种 DES 分离木质素的提取率用
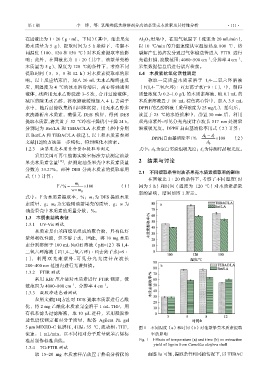
2.1 不同提取条件对油茶果壳木质素提取率的影响
式(1)计算:
在固液比 1∶20 的条件下,考察了不同温度(时
m
Y / % 1 100 (1) 间为 5 h)和时间(温度为 120 ℃)对木质素提取
wm 0 率的影响,结果如图 1 所示。
式中:Y 为木质素提取率,%;m 1 为 DES 提取木质
素质量,g;m 0 为实验用油茶果壳的质量,g;w 为
油茶果壳中木质素的质量分数,%。
1.3 木质素结构表征
1.3.1 UV-Vis 测试
木质素是由苯丙烷基组成的聚合物,具有良好
紫外吸收性能,但不溶于水,因此,将 10 mg 木质
素分别溶解于 100 mL NaOH 溶液(pH=12)和 1,4-
二氧六环溶液〔V(1,4-二氧六环)∶V(去离子水)=9∶
1 〕, 利用双光 束紫外 - 可 见分光 光度 计在波 长
200~400 nm 范围内进行光谱扫描。
1.3.2 FTIR 测试
采用 KBr 压片法对木质素进行 FTIR 测定,波
–1
–1
数范围为 4000~800 cm ,分辨率 4 cm 。
1.3.3 凝胶渗透色谱测试
参照文献[14]方法对 DES 提取木质素进行乙酰
化,将 2 mg 乙酰化木质素完全溶于 1 mL THF,用
有机系滤头过滤溶液,取 10 μL 进样,采用凝胶渗
透色谱仪测定相对分子质量,配备 Agilent PL gel
5 μm MIXED-C 色谱柱,柱温:35 ℃,流动相:THF, 图 1 不同温度(a)和时间(b)对油茶果壳木质素提取
流速:1 mL/min,以不同相对分子质量聚苯乙烯标 率的影响
准品制作标准曲线。 Fig. 1 Effects of temperature (a) and time (b) on extraction
yield of lignin from Camellia oleifera shell
1.3.4 TG-FTIR 测试
取 15~20 mg 木质素样品放置于热重分析仪的 由图 1a 可知,提取条件相同的情况下,以 TEBAC