Page 203 - 《精细化工)》2023年第10期
P. 203
第 10 期 杜永梅,等: 氧化玉米淀粉-聚己内酯基抗菌膜的制备及性能 ·2281·
–4
–5
600 nm 处的吸光度(OD 600 )。取 1×10 、1×10 、 上,合成了较高取代度的 OI。
–6
1×10 稀释液 200 µL 做涂布实验,每个梯度平行 3
组,调整菌悬液浓度。用平板菌落计数法测定其菌
8
液浓度,使其含菌体数为 1~2×10 CFU/mL,即为供
菌悬液。将抗菌药物(OCS 和 OI)混合在 30 mL LB
软琼脂(质量分数为 0.7%琼脂)中,倒在平板上待
其凝固,吸取不同浓度稀释后的菌液 5 µL 点板,放
2.2 OI 及 PO 样品的表征
置于 37 ℃过夜培养。根据实验结果,挑选出不长菌
2.2.1 FTIR 分析
的浓度作为抗菌测试菌液的浓度。
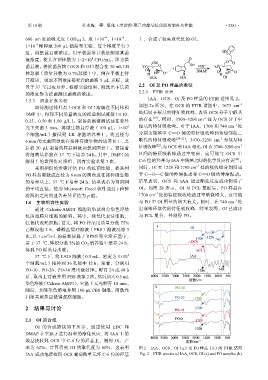
IAA、OCS、OI 及 PO 样品的 FTIR 谱图见 2。
1.5.3 圆盘扩散实验
如图 2a 所示,在 OCS 的 FTIR 谱图中,1673 cm –1
取待测固体样品(OCS 和 OI)溶解在不同体积
DMF 中,得到不同质量浓度的抑菌测试液体(0.10、 处归属于羰基的特征吸收峰,表明 OCS 分子中醛基
–1
0.25、0.50 和 1.00 g/L)。制备的溶液测试前在紫外 的存在 [19] 。同时,3500~3200 cm 处为 OCS 分子中
–1
光下灭菌 5 min。将微生物悬浮液(100 μL,1×10 6 羟基的特征吸收峰。对于 IAA,1700 和 740 cm 处
个细胞/mL)擦拭到 LB 琼脂培养基上。将直径为 分别为羧基中 C==O 键的特征吸收峰和芳烃邻位二
–1
6 mm 的无菌圆盘放在接种有微生物的培养皿上,之 取代的特征吸收峰 [20-21] ;3470~3250 cm 为氨基特
[22]
后将 20 μL 制备的样品溶液加载到圆盘上。紧接着 征吸收峰 。与 OCS 和 IAA 相比,OI 在 3700~3200 cm –1
将细菌培养物在 37 ℃下培养 24 h。其中,DMF(纯 区间的特征吸收峰透过率变弱,这可能与 OCS 中
溶剂)的盘用作对照组,所有实验重复 3 次。 C-6 位的羟基与 IAA 中羧基之间的化学反应有关 [23] 。
–1
采用相似的步骤评估 PO 的抗菌性能,将系列 同时,OI 在 1220 和 1700 cm 处的吸收峰分别归属
PO 样品剪裁成直径为 6 mm 的圆盘放在接种微生物 于 C—O—C 键的伸缩振动和 C==O 键的伸缩振动。
的培养基上,37 ℃下培养 24 h,结果表示为抑菌圈 结果表明,OCS 和 IAA 通过酯化反应成功制得了
的平均直径。使用 Microsoft Excel 软件通过 t 检验 OI。如图 2b 所示,OI 与 PCL 复配后,PO 样品在
–1
将两组之间的显著差异评估为 p 值。 1700 cm 处的特征吸收峰透过率略微增大,这可能
–1
1.6 生物相容性实验 与 PO 中 OI 用量的增大有关。同时,在 740 cm 处
通过 Calcein-AM/PI 细胞双染试剂盒染色评估 出现苯环取代的特征吸收峰,结果表明,OI 已成功
抗菌薄膜对细胞的影响。其中,绿色代表活细胞, 与 PCL 复合,并制得 PO。
红色代表死细胞。首先,将 PO 样品用质量分数 75%
乙醇浸泡 2 h,磷酸盐缓冲溶液(PBS)溶液洗涤 3
2
次。以 1 cm /mL 的标准浸提于 RPMI 完全培养基中,
置于 37 ℃、体积分数 5%的 CO 2 培养箱中培养 24 h,
得到 PO 样品浸出液。
37 ℃下,将 L929 细胞(0.5 mL,密度为 1×10 5
个细胞/mL)接种到 36 孔板中 12 h;接着,分别用
PO-10、PO-20、PO-30 浸出液处理。孵育 24 或 48 h
后,取出上清液并用 PBS 洗涤 2 次。然后加入 0.5 mL
染色溶液(Calcein-AM/PI),室温下无光孵育 10 min。
随后,去除染色溶液并用 100 µL PBS 润湿,用激光
扫描共聚焦显微镜观察细胞。
2 结果与讨论
2.1 OI 的合成
OI 的合成路线如下所示,通过使用 EDC 和
DMAP 在室温下进行温和的酯化反应,将 IAA 上的
羧基接枝到 OCS 中 C-6 位的羟基上,制得 OI,产
率为 62%。计算得到 OI 的取代度为 60%,这表明 图 2 IAA、OCS、OI(a)及 PO 样品(b)的 FTIR 谱图
IAA 成功地接枝到 OCS 葡萄糖单元环 C-6 位的羟基 Fig. 2 FTIR spectra of IAA, OCS, OI (a) and PO samples (b)