Page 13 - 《精细化工》2023年第11期
P. 13
第 11 期 邵伟春,等: 二氧化锰基电催化材料研究进展 ·2325·
的催化活性;采用计时电位法(E-t)和计时电流法 转移、反应能垒高,是电解水制氢的限制性因素 [52-53] 。
(i-t)等来评判电极的催化稳定性 [49-50] 。在电催化 研发具有高性能的催化电极能有效降低 OER 的活
裂解水制氢领域,主要根据反应过电位、Tafel 斜率 化能,加速反应的进行。非贵金属基催化材料成本
和性能保持率等参数来综合评估电极材料的催化性 低、结构可控,可作为良好的电解水催化剂 [54] 。其
能;此外,以产物转化率、法拉第效率、选择性等 中,MnO 2 材料具有储量丰富、价格低廉、性能优异
作为电极材料在氮还原、尿素氧化、二氧化碳还原 等优点,在 OER 催化领域中应用广泛。
和醇氧化等催化过程中的性能评价依据。 通过优化晶型、调控电子结构和增加活性位点
数,可提高 MnO 2 基电极材料的 OER 催化性能。研
4 MnO 2 电极材料的催化应用
究发现,MnO 2 的晶型结构与其电催化析氧性能存在
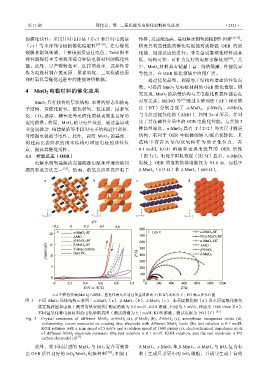
MnO 2 具有独特的层状结构、丰富的价态和价电 对应关系。MENG 等 [55] 通过非溶剂法(SF)和水热
子结构,在催化析氧、催化析氢、氮还原、尿素氧 法(HT)分别合成了 α-MnO 2 、β-MnO 2 、δ-MnO 2
化、CO 2 还原、醇氧化等电催化领域表现出良好的 与非晶型锰氧化物(AMO),如图 3a~d 所示,并对
应用前景。然而,MnO 2 的导电性较差,通过金属或 比了其在碱性介质中的 OER 电催化性能。与其他 3
非金属掺杂、构建缺陷等手段对电子结构进行调控, 种晶型相比,α-MnO 2 具有 T(2×2)的大尺寸隧道
可增强电极的导电性。此外,调变 MnO 2 的晶型、 结构,有利于 OER 中间体的嵌入/脱出和转化,其
构建高比表面积的纳米结构可增加电极的活性位 结构中存在大量的双氧桥作为质子化位点,在
点,提高其催化活性。 0.1 mol/L KOH 溶液中表现出优异的 OER 活性
4.1 析氧反应(OER) (图 3e)。电化学阻抗数据(图 3f)显示,α-MnO 2
电解水制氢是解决当前能源短缺和环境污染问 电极上 OER 的电荷转移电阻仅为 91.8 Ω,远低于
题的有效方法之一 [51] 。然而,析氧反应涉及四电子 β-MnO 2 (613 Ω)和 δ-MnO 2 (666 Ω)。
a~d 中橙色代表[MnO 6]八面体,蓝色代表允许通过的金属阳离子(如 K )或水分子;PG 表示多孔石墨
+
图 3 不同 MnO 2 晶体结构示意图:α-MnO 2 (a)、β-MnO 2 (b)、δ-MnO 2 (c)、非晶锰氧化物(d)及不同锰氧化物负
载在旋转圆盘电极上测得的伏安曲线(测试溶液为 0.1 mol/L KOH 溶液,扫速为 5 mV/s、转速为 1600 r/min)(e),
不同锰氧化物电极材料的电化学阻抗图(测试溶液为 0.1 mol/L KOH 溶液,测试电极为 PG)(f) [55]
Fig. 3 Crystal structures of different MnO 2 : α-MnO 2 (a), β-MnO 2 (b), δ-MnO 2 (c), amorphous manganese oxide (d),
voltammetry curves measured on rotating disc electrode with different MnO 2 loads (the test solution is 0.1 mol/L
KOH solution with a scan speed of 5 mV/s and a rotation speed of 1600 r/min) (e), electrochemical impedance plots
of different MnO 2 electrode materials (the test solution is 0.1 mol/L KOH solution, and the test electrode is PG
carbon electrode) (f) [55]
此外,将不同晶型的 MnO 2 与 IrO 2 复合可制备 δ-MnO 2 、γ-MnO 2 和 β-MnO 2 ,α-MnO 2 与 IrO 2 复合有
出 OER 活性良好的 IrO 2 /MnO 2 电极材料 [56] 。相较于 利于生成尺寸更小的 IrO 2 微粒,并诱导生成丰富的