Page 241 - 《精细化工》2023年第2期
P. 241
第 2 期 赵传武,等: 喹啉多环系列化合物的一锅法合成 ·463·
1
环上吸电子取代基不利于环合反应进行,收率略低 当反应底物中 R 为甲氧基,相比反应底物 R 1
(Ⅲd 的收率为 80.3%)。当亲核试剂为吡啶氨基酚 为 F 时,同一亲核试剂(Ⅱa~Ⅱg)亲核取代环合反
类(Ⅱf 和Ⅱg)时,反应底物无论是Ⅰa 还是Ⅰb,环 应的收率均有所下降(56.3%~89.4%)。这是因为反
合产物的收率均较高,由此说明相比邻氨基苯酚类, 应底物中甲氧基作为给电子基团不利于氟原子离
缺电子的吡啶环能提高酚羟基和氨基的亲核能力, 去,使得环合反应受阻。最后,在上述最佳反应条
从而促进亲核取代反应的进行。 件下,验证了环合反应对反应底物和非芳香类双亲
核试剂的适用范围(序号 15~20)。乙二胺与 1,2-环
表 3 喹啉多元环衍生物
Table 3 Quinoline polycyclic compounds 己二胺具有较强的碱性和亲核能力,环合产物(Ⅲo~
Ⅲr)收率均在 95%以上,而乙醇胺作为亲核试剂时,
序号 Ⅰ Ⅱ Ⅲ 收率/%
无论是Ⅰa 还是Ⅰb,在相同的反应条件均得不到环
1 Ⅰa 邻氨基苯酚(Ⅱa) Ⅲa 83.7
合产物,这说明非芳香类醇羟基较弱的亲核能力不
2 Ⅰa 2-氨基苯硫酚(Ⅱb) Ⅲb 81.6
利于亲核氟取代反应的进行,该类型亲核底物不适
3 Ⅰa 邻苯二胺(Ⅱc) Ⅲc 86.4
4 Ⅰa 2-氨基-5-氟苯酚(Ⅱd) Ⅲd 80.3 用该环合反应。
5 Ⅰa 2-氨基-4-甲氧基苯酚(Ⅱe) Ⅲe 85.6 2.4 反应机理推测
6 Ⅰa 3-羟基-4-氨基吡啶(Ⅱf) Ⅲf 95.8 根据实验事实,推测环合反应机理如图 6 所示。
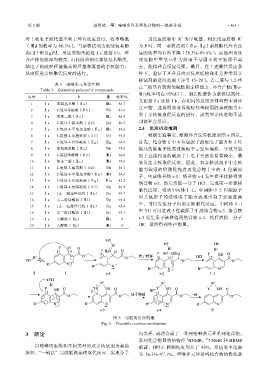
7 Ⅰa 3-氨基-4-羟基吡啶(Ⅱg) Ⅲg 94.5 首先,化合物Ⅰ中 4 位氯原子的吸电子能力和 3 位
8 Ⅰb 邻氨基苯酚(Ⅱa) Ⅲh 75.0 羰基的缺电子性质致使电子云发生偏移,导致与氯
9 Ⅰb 2-氨基苯硫酚(Ⅱb) Ⅲi 64.0 原子直接相连的碳原子上电子云密度显著减小,最
10 Ⅰb 邻苯二胺(Ⅱc) Ⅲj 79.0 易发生亲核取代反应。因此,双亲核试剂Ⅱ中亲核
11 Ⅰb 2-氨基-5-氟苯酚(Ⅱd) Ⅲk 56.3
能力较强的伯胺优先进攻化合物Ⅰ中的 4 位碳原
12 Ⅰb 2-氨基-4-甲氧基苯酚(Ⅱe) Ⅲl 59.4
子,生成络合物 s-1,络合物 s-1 发生质子转移得到
13 Ⅰb 3-氨基-4-羟基吡啶(Ⅱg) Ⅲm 81.2
络合物 s-2,然后消除一分子 HCl,完成第一步亲核
14 Ⅰb 3-羟基-4-氨基吡啶(Ⅱf) Ⅲn 89.4
取代反应,得到中间体Ⅰ-1。中间体中 5 位碳原子
15 Ⅰa 1,2-二氨基环己烷(Ⅱh) Ⅲo 95.7
因其氟原子的强吸电子能力表现出电子云密度减
16 Ⅰa 乙二胺盐酸盐(Ⅱi) Ⅲp 96.4
少,可以发生分子内的亲核取代反应。中间体Ⅰ-1
17 Ⅰb 1,2-二氨基环己烷(Ⅱh) Ⅲq 95.4
中 YH 可以进攻 5 位碳原子生成络合物 s-3,络合物
18 Ⅰb 乙二胺盐酸盐(Ⅱi) Ⅲr 97.1
19 Ⅰa 乙醇胺(Ⅱj) Ⅲs 0 s-3 发生质子转移得到络合物 s-4,然后消除一分子
20 Ⅰb 乙醇胺(Ⅱj) Ⅲt 0 HF,最终得到终产物Ⅲ。
图 6 可能的反应机理
Fig. 6 Plausible reaction mechanism
3 结论 内关环,成功合成了一系列喹啉多元环系列化合物。
1
13
系列化合物Ⅲ的结构经 HNMR、 CNMR 和 HRMS
以喹啉衍生物和不同类型的双亲核试剂为起始 确证,HPLC 检测纯度均大于 98%,反应收率范围
原料,“一锅法”完成联级亲核取代反应,实现分子 为 56.3%~97.1%。喹啉多元环系列化合物的优化条