Page 208 - 《精细化工》2023年第5期
P. 208
·1128· 精细化工 FINE CHEMICALS 第 40 卷
2.5 不同阴离子下体系电流及电导率变化
在电压为 15 V、初始 pH 为 7 的条件下,考察
了共存阴离子种类对反应过程中体系电流及电导率
的影响,结果如表 3 所示。溶液电导率越高,理论
上溶液导电能力越好,越有利于体系电化学反应的
进行 [24] 。对比模拟水系和 3 种阴离子水系,其中 NaCl
水系溶液电导率较低,但初始电流较高(600 mA);
Na 2SO 4 水系和 Na 2SO 3 水系的初始电导率分别为 5.07
和 5.10 mS/cm,但初始电流仅为 55 和 18 mA,体系
初始电流相差巨大。向模拟水系中加入 3 种阴离子
钠盐形成共存体系。与模拟水系相比,电解质的加
入都使溶液电导率升高,其中氯盐和硫酸盐的加入
–
有效提升了体系电流,Cl 体系中电流最高,电化学
反应速率最快。亚硫酸盐的加入导致体系电流下降,
影响电化学反应进行。由此可知,共存阴离子种类
–
对体系电流影响较大,Cl 的加入可显著提升体系电
流,提高电化学反应速率。
表 3 不同水系条件下体系电流及电导率变化
Table 3 Changes of current and conductivity under different
water system conditions
① 初始电流 终止电流 初始电导率 终止电导率
水系条件
/mA /mA /(mS/cm) /(mS/cm)
模拟水系 51 131 4.89 4.74
NaCl 水系 600 640 4.91 4.86
Na 2SO 4 水系 55 110 5.07 4.88
Na 2SO 3 水系 18 45 5.10 4.90
NaCl+模拟水系 1003 1170 7.87 8.43
Na 2SO 4+模拟水系 65 336 9.88 10.18
Na 2SO 3+模拟水系 42 29 9.70 10.05
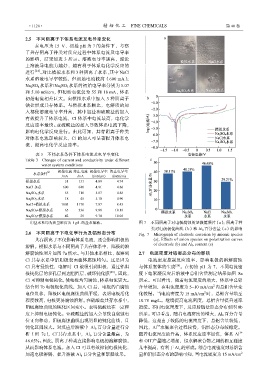
①盐水系均为质量浓度为 1 g/L 的盐水溶液。 图 7 不同阴离子对电极腐蚀的显微镜照片(a);阴离子种
类对电极极化曲线(b)和 Al b 百分含量(c)的影响
2.6 不同阴离子下电化学行为及铝形态分布 Fig. 7 Micrograph of electrode corrosion by anionic species
共存阴离子不仅影响体系电流,还会影响阳极的 (a); Effects of anion species on polarization curves
of electrode (b) and Al b content (c)
溶解。模拟水系与不同阴离子共存体系中,阳极的溶
解腐蚀性照片如图 7a 所示。与其他水系相比,观察到 2.7 电流密度对铝形态分布的影响
–
Cl 共存水系中铝阳极表面整体腐蚀均匀。这是因为 电流密度控制反应速率,影响电极的溶解腐蚀
–
–
Cl 具有侵蚀性,电解时 Cl 被吸引到阳极,通过铝阳 与体系絮体的生成 [26] 。在初始 pH 为 7,不同电流密
极钝化层的多孔层到达阻挡层,破坏钝化膜 [25] 。因此, 度下电絮凝反应后溶液中总铝含量测定结果如图 8a
–
Cl 可抑制电极钝化,使电极均匀腐蚀,体系电流更大。 所示。可以看出,随着电流密度的增大,体系中总铝
–
2
结合图 7b 电极极化曲线,加入 Cl 后,电极的自腐蚀 含量增加,在电流密度为 5~10 mA/cm 内总铝含量变
2
电位负移,阳极区电极腐蚀曲线平缓,表明电极活化 化较慢。当电流密度为 15 mA/cm 时,总铝含量增至
程度较高,电极更易腐蚀溶解。在硫酸盐共存水系中, 10.78 mg/L。继续提高电流密度,总铝含量提升速率
阳极腐蚀曲线的钝化区间变小。表明硫酸盐在一定程 趋缓。不同电流密度下,反应后铝盐形态分布如图 8b
度上抑制电极钝化。亚硫酸盐的加入会导致自腐蚀电 所示。可以看出,随着电流密度的增大,Al b 百分含量
位正向移动,阳极腐蚀曲线出现明显的钝化曲线,且 降低,这是由于较低的电流密度下,总铝含量较低,
3+
钝化区间较大。对反应后溶液中 Al b 百分含量进行分 因此,Al 水解聚合过程较慢,铝形态分布较稳定。
–
析(图 7c),Cl 共存水系中,Al b 百分含量最高,为 随着电流密度的升高,体系反应速率加快,体系 Al 3+
–
46.65%。因此,阴离子种类直接影响电极的溶解腐蚀, 和 OH 产量随之增加,铝水解聚合物之间的相互碰撞
–
从而影响体系电流。加入 Cl 可以有效抑制电极钝化, 几率提高,有利于 Al c 的形成。综合电流密度对总铝含
加速电极溶解,提升溶液 Al b 百分含量和絮凝效果。 量和铝形态分布的影响可知,当电流密度为 15 mA/cm 2