Page 127 - 201810
P. 127
第 10 期 周进康,等: 单宁酸/硫酸掺杂聚邻甲氧基苯胺的吸附性能 ·1735·
3+
3+
从图 4 可知,当 Cr 质量浓度在 0.01~0.1 g/L 范 由图 6 可知,3 h 时 POMA-H-GA 对 Cr 的吸
围增加时,吸附量呈较快上升趋势,最高为 17.3 mg/g; 附量为 17.6 mg/g、吸附率升至 92.9%,前述低浓度
在 0.09~0.1 g/L 时吸附率较高接近 93%,于是,选 时吸附类型是化学吸附,化学反应需要时间,所以
3+
择 Cr 质量浓度为 0.1 g/L 作为后续吸附实验浓度。 吸附时间较长,吸附作用力较强,因此吸附率较高;
采用 Scatchard 模型评价 POMA-H-GA 吸附特征 [21] , 而在高浓度时(20 g/L 时吸附量达 467 mg/g),吸附
Scatchard 方程如下: 平衡时间为 1.5 h,这是因为高浓度时,吸附行为可
(3) 能以物理吸附为主,吸附速率较快,吸附量较大,
Q/ρ 0 = Q max /K d -Q/K d
3+
式中:Q 为吸附量,mg/g;ρ 0 为吸附液中 Cr 初始 但吸附作用力较弱,吸附平衡后,吸附量有上下波
浓度,g/L;Q max 为最大表观吸附量,mg/g;K d 为吸 动的现象。将图 6 的数据进行动力学准一级(式 4)
附平衡解离常数,mg/L。 和准二级(式 5)方程拟合,对反应级数和吸附机
以 Q/ρ 0 对 Q 作图得 Scatchard 吸附曲线如图 5 理进行考察 [21] 。
所示。 ln(Q e –Q t ) = lnQ e – k 1 t (4)
t/Q t =1/(Q e k 2 ) + t/Q e (5)
式中:Q e 、Q t 分别为吸附平衡和 t 时的吸附量,mg/g;
t 为吸附时间,h;k 1 、k 2 分别为准一级、准二级反应
速率常数,mg/(g·h)。
拟合结果为准一级动力学方程所得吸附量 Q
(16.7 mg/g)与实测值(17.6 mg/g)较为接近,其
2
准一级模型拟合相关系数为(R =0.9926),相比较
2
准二级模型拟合相关系数(R =0.9744)更高,即
3+
POMA-H-GA 对 Cr 吸附过程基本符合准一级动力
学模型,吸附过程以化学吸附为主。结合 2.7.1 节吸
图 5 Scatchard 吸附曲线
Fig. 5 Scatchard adsorption curve 附类型分析,进一步证实,在低浓度(0.1 g/L)时,
POMA-H-GA 的吸附行为主要为化学吸附。
由图 5 可知,曲线呈一种良好的线性关系,线 2.7.3 温度的选择性
2
性方程为:y = 0.7614x + 156.9,R = 0.9874;因此 3+
在硝酸铬溶液中,POMA-H-GA 对 Cr 的吸附
吸附表现为一种类型的吸附行为,可能主要为化学 性能随温度的变化曲线如图 7 所示。
吸附,在较稀的溶液中吸附剂与吸附质接触机会较
少,靠物理作用结合的几率较小,相比高浓度时单
3+
位质量吸附剂的吸附量较低(Cr 质量浓度为 20 g/L
时吸附达 467 mg/g),化学吸附就起主导作用,其吸
附作用力强,这对吸附率的提高有利。
2.7.2 动态吸附
3+
在硝酸铬溶液中,POMA-H-GA 对 Cr 的吸附
性能随吸附时间的变化如图 6 所示。
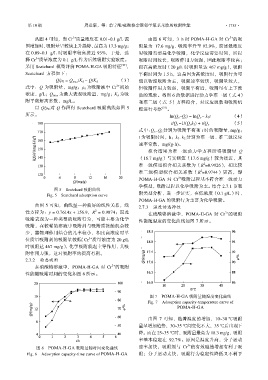
图 7 POMA-H-GA 吸附量随温度变化曲线
Fig. 7 Adsorption capacity-temperature curve of
POMA-H-GA
由图 7 可知,随着温度的增加,10~30 ℃吸附
量呈增加趋势,30~35 ℃间变化不大,35 ℃后出现下
降。而在 25~35 ℃时,吸附量最高为 18.3 mg/g,吸附
率基本稳定在 92.7%。原因是温度升高,分子运动
3+
图 6 POMA-H-GA 吸附量随时间变化曲线 速率加快,吸附剂与 Cr 的有效碰撞增加有利于吸
Fig. 6 Adsorption capacity-time curve of POMA-H-GA 附;分子运动太快,吸附行为稳定性降低又不利于