Page 128 - 201810
P. 128
·1736· 精细化工 FINE CHEMICALS 第 35 卷
2+
2+
2+
吸附,同时升高温度需要消耗能源,所以,选择 25 ℃ Hg >Pb >Cd 。可以看出,低浓度(0.1 g/L)
2+
3+
作为吸附温度。 时,POMA-H-GA 可以用于 Cr 、Cd 混合液的处
2+
3+
2.7.4 吸附体系酸度优化 理;POMA-H-GA 对 Cr 、Cd 混合液具有一定的
3+
在硝酸铬溶液中,POMA-H-GA 对 Cr 的吸附 选择性。
性能随溶液 pH 的变化如图 8 所示。 在硝酸铬溶液中,加入盐酸、硫酸、月桂酸、
3+
磷酸、醋酸时,POMA-H-GA 对 Cr 吸附量变化如
图 10 所示。
图 8 POMA-H-GA 吸附量随 pH 变化曲线
Fig. 8 Adsorption capacity-pH curve of POMA-H-GA
从图 8 可知,pH=2.5~4.5,吸附量变化平稳, 图 10 几种阴离子的竞争吸附
4.5 之后呈下降趋势,当 pH 增大到 5 后,吸附量下 Fig. 10 Rival adsorption of several anions
降速率增大,且 pH 接近 5 时,吸附液有浑浊现象,
从图 10 可知,这几种阴离子对 POMA-H-GA
有氢氧化物生成;同时,较低的 pH 需要用酸进行
3+
吸附性能均有影响,对 Cr 吸附量影响大小顺序是
调节,所以选择吸附液 pH=3.0~4.5,实验室配制的 Cl >SO >R 11 COO >CH 3 COO >PO ,即 Cl 影
3
2
3+
Cr 溶液模拟废水,不需要进行酸碱调节,实际含 4 4
响最大,这是 Cl 较强的渗透性能造成的。硫酸有一
铬废水 pH 需要调节至 4.5 以下。
3+
6+
定的氧化性,Cr 可被氧化为 Cr ,R 11 COO 长链结
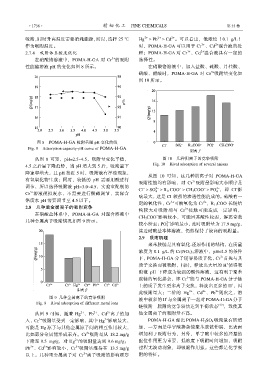
2.8 几种重金属离子的吸附竞争
3+
构较大对吸附剂与 Cr 接触可能造成一定影响,
在硝酸盐体系中,POMA-H-GA 对混合溶液中
CH 3 COO 影响较小,可能因其酸性较弱,解离常数
几种金属离子吸附情况如图 9 所示。 较小所至;PO 影响最小,此时吸附量为 17.9 mg/g,
3
4
接近硝酸盐本体溶液,仍然保持了较高的吸附量。
2.9 吸附机理
聚苯胺链是具有氧化-还原作用的结构,在质量
浓度为 0.1 g/L 的 Cr(NO 3 ) 3 溶液中,pH<4.5 的条件
3+
下,POMA-H-GA 分子链容易质子化,Cr 首先与其
+
质子交换而被吸附,同时,释放出大量的 H 使得吸
附液 pH 下降成为较强的酸性溶液,这有利于聚苯
3+
胺链的氧化掺杂,即 Cr 能与 POMA-H-GA 分子链
+
上的质子发生更多离子交换,释放出更多的 H ,因
2+ 2+ 2+
此吸附量大;二价的 Hg 、Cd 、Pb 则次之,溶
图 9 几种金属离子的竞争吸附 液中较多的 H 与金属离子一起对 POMA-H-GA 分子
+
Fig. 9 Rival adsorption of different metal ions [22]
链吸附-脱附的竞争较快达到平衡状态 ,致使其
2+
2+
2+
从图 9 可知,随着 Hg 、Pb 、Cd 离子的加 他金属离子的吸附量不高。
2+
3+
入,Cr 吸附量受到一定影响,其中 Hg 影响最大, POMA-H-GA 相比 POMA-H 2 SO 4 吸附量有所增
可能是 Hg 原子与其他金属原子间的相互作用较大, 加,一方面是单宁酸掺杂使聚苯胺链伸展,比表面
3+
比如部分金属能形成汞齐。Cr 吸附量从 18.2 mg/g 增加利于吸附行为,另外,单宁酸中较多的羟基的
2+
下降至 9.5 mg/g,对 Hg 的吸附量达到 9.6 mg/g; 配位作用更为重要,低浓度下吸附时间增加,吸附
3+
2+
2+
Pb 、Cd 影响较小,Cr 吸附量维持在 13.5 mg/g 过程无波动现象,即吸附作用强。这些都是化学吸
3+
以上。几种重金属离子对 Cr 离子吸附的影响顺序 附的特征。