Page 208 - 201906
P. 208
·1214· 精细化工 FINE CHEMICALS 第 36 卷
为+2 价,还测试了样品的俄歇电子能谱,见图 6B。
TiO 2 纳米纤维与 P25 负载 CuO 后的 CuLMM 俄歇电
子能谱见图 6B。俄歇动能峰值均位于 917.6 eV,这
是+2 价 Cu 的特征峰 [24] 。
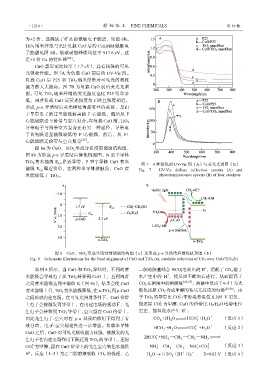
CuO 禁带宽度较窄(1.7 eV),具有较强的可见
光吸收性能。图 7A 为负载 CuO 前后的 UV-Vis 图。
负载 CuO 后 P25 和 TiO 2 纳米纤维对可见光的吸收
能力都大大提高。图 7B 为负载 CuO 前后荧光光谱
图。可见 TiO 2 纳米纤维的荧光强度也比 P25 明显要
低,两者负载 CuO 后荧光强度均下降且强度相近。
形成 p-n 异质结后荧光峰位置都有些许蓝移,是由
于导带电子跃迁至能级较高的 F 心能级,随后从 F
心能级跃迁至价带与空穴复合。在负载 CuO 前,TiO 2
导带电子与价带空穴复合还有另一种途径,导带电
子首先跃迁至能级较低的 F+心能级,然后,从 F+
心能级跃迁价带与空穴复合 [25] 。
图 8a 为 CuO、TiO 2 形成异质结前能级结构图,
图 8b 为形成 p-n 异质结后催化机理图,N 型半导体
TiO 2 费米能级 E f,n 靠近导带,P 型半导体 CuO 费米
图 7 4 种催化剂 UV-Vis 图(A)与荧光光谱图(B)
能级 E f,p 靠近价带,在两种半导体接触前,CuO 费 Fig. 7 UV-Vis diffuse reflection spectra (A) and
米能级低于 TiO 2 。 photoluminescence spectra (B) of four catalysts
图 8 CuO、TiO 2 形成异质结前能级结构图(a)及形成 p-n 异质结后催化机理图(b)
Fig. 8 Schematic illustrations for the band alignment of CuO and TiO 2 (a), catalytic reduction of CO 2 over CuO/TiO 2 (b)
–
+
如图 8 所示,当 CuO 和 TiO 2 异结时,不同的费 二胺的胺基结合 HCO 3电离出的 H ,消耗了 CO 2 溶于
+
米能级会导致电子从 TiO 2 转移到 CuO 上,直到两者 水产生中的 H ,使反应不断向右进行,从而提高了
之间费米能级达到平衡值 E f (图 8b),结果会使 CuO CO 2 在溶液中的溶解度 [26-27] ;溶液中反应(4~5)为光
费米能级上升,TiO 2 费米能级降低,在 n-TiO 2 到 p-CuO 催化还原 CO 2 合成甲醇的各基元反应的电势 [28-29] ,由
2–
之间形成内建电场。在可见光照射条件下,CuO 价带 于 TiO 2 的导带比 CO 3 /甲醇电势电位 0.209 V 更负,
2–
上电子会被激发到导带上,在内建电场的驱动下,光 能还原 CO 3 为甲醇,CuO 的价带比 O 2 /H 2O 电势电位
+
生电子会转移到 TiO 2 导带上,空穴留在 CuO 价带上, 更正,能氧化水产生 H 。
+
因此光生电子-空穴对在 p-n 异质结作用下得到了有 CO +2H O HCO +H O (反应 1)
3
2
3
2
效分离,电子-空穴稳定性进一步增强。负载半导体 HCO +H O CO +H O (反应 2)
2
+
CuO 之后,CuO 对可见光吸收能力较强,被激发的光 3 2 3 3
2 H C O + N H C — H C — H N — H
生电子在内建电场作用下跃迁到 TiO 2 的导带上,还原 3 2 2 2 2
2–
CO 3 为甲醇,留在 CuO 价带上的光生空穴氧化水提供 NH — 3 CH — 2 CH — 2 NH +CO 2 3 (反应 3)
3
+
+
H 。反应(1~3)为乙二胺溶液吸收 CO 2 的机理,乙 H O 1/ 2O +2H +2e E=0.82 V (反应 4)
2
2