Page 107 - 《精细化工》2020年第9期
P. 107
第 9 期 李诗浩,等: 红细胞膜封装负载姜黄素的金纳米粒子 ·1821·
M M 含样品的 FBS 或 PBS 溶液,通过纳米粒度电位分析
R /% Cur Sup 100 (2)
M Au 仪测量 Au-Cur@RBC 的水合粒径。每个样品平行扫
式中:E 为吸附率,%;M Cur 为姜黄素的总质量,g; 描 5 次。
M Sup 为上清液中姜黄素的质量,g;R 为载药率,%; 暗视场显微镜测试:将制备的 Au-Cur NPs 与
M Au 为 Au-Cur NPs 的总质量,g。 Au-Cur@RBC 各稀释一定倍数后(根据在显微镜视
1.2.4 RBC 与 Au-Cur@RBC 的制备 野中的分布判断稀释比例),分别滴取少量的稀释液
通过将 Au-Cur NPs 与 RBC 血影混合(Au-Cur 于载玻片上,待样品风干后固定并置于显微镜暗视
NPs 分散液与全血制备的细胞膜的体积比为 1∶5), 场下观测。暗场聚光镜〔镜口率(NA)=1.25〕;10×
使用脂质体挤出器反复挤压通过 200 nm 聚碳酸酯 物镜,16×目镜;光源为 20 W 卤素灯。
膜以将纳米颗粒封装入 RBC 内 [10] 。具体步骤为:取
1 mL 新鲜绵羊全血,在 4 ℃下 800 r/min 离心 5 min, 2 结果与讨论
弃去上清液,获得的 RBC 使用预冷的 10 mmol/L 磷
2.1 金纳米颗粒的表征
酸盐缓冲液(PBS)10 mL 洗涤 3 次。细胞内含物
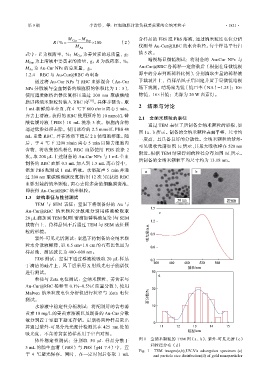
通过 TEM 表征了所制备金纳米颗粒的形貌,如
通过低渗处理去除。使用冰冷的 2.5 mmol/L PBS 40
图 1a、b 所示。制备的金纳米颗粒表面平整,尺寸均
mL 重悬 RBC,并在冰浴下稳定 2 h 使细胞溶胀。随
一度高,且具备良好的分散性。金纳米颗粒的紫外-
后,于 4 ℃下 1200 r/min 离心 5 min 以除去细胞内
可见吸收光谱如图 1c 所示,其最大吸收峰在 520 nm
含物,将收集的浅粉色 RBC 血影使用 PBS 洗涤 2
附近。根据 TEM 结果得到的粒径分布如图 1d 所示。
次。取 200 μL 上述制备的 Au-Cur NPs 与 1 mL 全血
所制备的金纳米颗粒平均尺寸约为 13.18 nm。
制备的 RBC 血影 0.5 mL 加入到 1.5 mL 离心管中,
添加 PBS 配制成 1 mL 溶液。水浴超声 5 min 并通
过 200 nm 聚碳酸酯膜反复挤出(12 次)以获得 RBC
血影封装的纳米颗粒,离心去除多余的细胞膜囊泡,
即获得 Au-Cur@RBC 纳米颗粒。
1.3 结构表征与性能测试
TEM 与 SEM 表征:室温下将制备好的 Au 与
Au-Cur@RBC 纳米颗粒分散液分别用移液枪吸取
20 μL 滴加到 TEM 铜网(需滴加磷钨酸复染) 与 SEM
载物台上,待样品风干后通过 TEM 与 SEM 表征颗
粒的形貌。
紫外-可见光谱测试:室温下将制备的金纳米颗
粒水分散液稀释,以 0.5 cm×1.0 cm 的石英比色皿为
样品池,测试波长为 400~600 nm。
EDS 测试:室温下通过移液枪吸取 20 μL 样品
于清洁的硅片上,风干后采用 X 射线光电子能谱仪
进行测试。
粒径与 Zeta 电位测试:金纳米颗粒、姜黄素与
Au-Cur@RBC 稀释至 0.1%~0.5%(质量分数),使用
Malven 纳米粒度电位分析仪进行粒径与 Zeta 电位
测试。
水溶液中稳定性分析测试:将配制好的含有姜
黄素 10 mg/L 的姜黄素溶液以及制备的 Au-Cur 分散
液分别置于室温下避光存储。定期将两种样品取出
并通过紫外-可见分光光度计检测其在 425 nm 处的
吸光度,不含姜黄素的样品用于空白对照。
体外稳定性测试:分别取 50 μL 样品分散于 图 1 金纳米颗粒的 TEM 图(a、b)、紫外-可见光谱(c)
5 mL 的胎牛血清(FBS)与 PBS(pH 7.4)中,置 和粒径分布(d)
Fig. 1 TEM images(a,b),UV-Vis adsorption spectrum (c)
于 4 ℃避光保存。同时,在一定时间后各取 1 mL and particle size distribution(d) of gold nanoparticles