Page 158 - 《精细化工》2021年第8期
P. 158
·1652· 精细化工 FINE CHEMICALS 第 38 卷
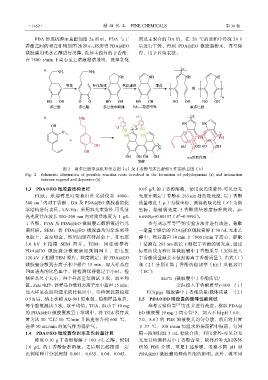
PDA 形成机理示意图如图 2a 所示,PDA 与丁 剂及未聚合的 DA 后,在–20 ℃的冰箱中冷冻 24 h
香酚之间的相互作用如图 2b 所示。将所得 PDA@EO 后进行干燥,得到 PDA@EO 微胶囊粉末,真空保
微胶囊用无水乙醇进行沉降,洗掉未包封的丁香酚, 存,用于后续表征。
在 7800 r/min 下离心至上清液澄清透明,洗掉乳化
图 2 聚多巴胺形成机理示意图(a)及丁香酚与多巴胺相互作用示意图(b)
Fig. 2 Schematic illustration of possible reaction route involved in the formation of polydopamine (a) and interaction
between eugenol and dopamine (b)
1.3 PDA@EO 微胶囊结构表征 0.05 g/L 的丁香酚溶液,使用双光束紫外-可见分光
FTIR:采用傅里叶变换红外光谱仪在 4000~ 光度计测定丁香酚在 283 nm 处的吸光度,以丁香酚
–1
500 cm 内对丁香酚、DA 及 PDA@EO 微胶囊的化 质量浓度(ρ)为横坐标,测得的吸光度(A)为纵
学结构进行表征。UV-Vis:采用双光束紫外-可见分 坐标,绘制吸光度-丁香酚质量浓度标准曲线。A=
2
光光度计在波长 500~200 nm 内对质量浓度为 1 g/L 6.6949ρ+0.00157(R =0.9994)。
丁香酚、PDA 及 PDA@EO 微胶囊乙醇溶液进行光 参考刘志军等 [28] 的实验方法并进行改进。称取
谱扫描。SEM:将 PDA@EO 微胶囊均匀涂抹到导 一定量干燥后的 PDA@EO 微胶囊溶于 30 mL 无水乙
电胶上,真空喷金,然后固定在样品台上,在电压 醇中,然后超声 30 min 于 7800 r/min 下离心,提取
3.0 kV 下拍摄 SEM 图片。TEM:用注射器将 上清液在 283 nm 波长下测定丁香酚的吸光度,通过
PDA@EO 微胶囊分散液滴加到铜网上,在电压 标准曲线方程计算微胶囊中丁香酚质量(实际投入
120 kV 下拍摄 TEM 照片。粒度测定:将 PDA@EO 丁香酚质量减去未包封游离丁香酚质量),由式(1)
微胶囊分散到去离子水中超声 15 min,加入样品在 和(2)分别计算丁香酚的包封率(EE)及包封量
四面透光的比色皿中,待检测仪器稳定半小时,检 (EC):
测样品尺寸大小,每个样品重复测试 3 次,取平均 EE/%=(微胶囊中丁香酚质量/
值。Zeta 电位:将样品分散到去离子水中超声 15 min, 实际投入丁香酚质量)×100 (1)
加入样品在四面透光的比色皿中,待检测仪器稳定 EC/(g/g)=微胶囊中丁香酚质量/载体质量 (2)
0.5 h 后,插上水相 AQ-961 钯电极,检测样品电位, 1.5 PDA@EO 微胶囊的缓释性能测试
每个重复测试 3 次,取平均值。TGA:取小于 10 mg 参考孟祥俭等 [29] 方法并进行改进。称取 PDA@
的 PDA@EO 微胶囊放置于坩埚中,将 TGA 程序设 EO 微胶囊 10 mg 于离心管中,加入不同 pH(6.0、
置为从 50 ℃以 10 ℃/min 升温速率升到 600 ℃, 7.0、8.0)的 PBS 溶液使其均匀分散,然后将其置
选择 50 mL/min 的氮气作为保护气。 于 37 ℃、100 r/min 恒温水浴振荡箱中振荡,每间
1.4 PDA@EO 微胶囊包封率及包封量计算 隔一段时间取 3 mL 释放介质,利用紫外-可见分光
称取 0.10 g 丁香酚溶解于 100 mL 乙醇,配制 光度计检测样品中丁香酚含量,取样后补充同等体
1.0 g/L 的丁香酚标准溶液。之后用乙醇按照一定 积的 PBS 介质,重复上述步骤,考察不同 pH 对
比例稀释并分别配制 0.001、0.035、0.04、0.045、 PDA@EO 微胶囊的释药性能的影响。此外,将不同