Page 39 - 《精细化工》2022年第2期
P. 39
第 2 期 张文君,等: 周期性介孔有机硅的合成及在生物医药领域的应用进展 ·243·
实现还原响应。细胞内外的 GSH 浓度不同,肿瘤细 具有更好的血液相容性,桥联不同功能性的基团和
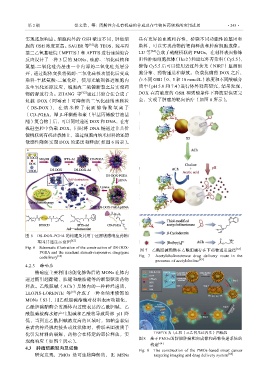
胞的 GSH 浓度更高。SAUER 等 [61] 将 TEOS、巯基丙 染料,可以实现药物的靶向释放和肿瘤细胞成像。
基三乙氧基硅烷(MPTES)和 APTES 进行连续缩合 LU 等 [64] 合成了硫醚桥联的 PMOs,在材料表面修饰
反应设计了一种 3 层的 MONs,硫醇-二氧化硅核和 阳性肿瘤细胞抗体(Her2)和近红外菁染料(Cy5.5),
氨基-二氧化硅壳层由一个内部的二氧化硅壳层分 修饰 Cy5.5 后可以使用近红外荧光(NIRF)监测细
开,通过配体交换将硫醇-二氧化硅核功能化后变成 胞分布、药物递送和释放。负载抗癌药 DOX 之后,
染料-半胱氨酸-二氧化硅,使用光敏剂促进细胞内 在不同 GSH(0、5 和 10 mmol/L)浓度和不同酸碱介
发生氧化还原反应,细胞内二硫键断裂之后实现药 质中(pH 5.0 和 7.4)进行体外释药研究,结果发现,
物的释放行为。ZHANG 等 [62] 通过共缩合法合成了 DOX 在高浓度的 GSH 和强酸条件下释放更快更完
负载 DOX(阿霉素)可降解的二氧化硅纳米颗粒 全,实现了肿瘤的靶向治疗(如图 8 所示)。
( DS-DOX ),在 纳米粒子 表面修饰 聚氧离 子
〔CD-PGEA,即 β-环糊精和聚(甲基丙烯酸甘油基
酯)复合物〕后,可以同时递送 DOX 和 DNA,在有
机硅空腔中负载 DOX,同时将 DNA 链通过非共价
键桥联到有机硅载体上,通过细胞内纳米材料的还原
敏感性降解实现 DOX 的递送和释放(如图 6 所示)。
图 6 DS-DOX-PGEA 的构建及其用于还原敏感响应药物/
基因共递送示意图 [62]
Fig. 6 Schematic illustration of the construction of DS-DOX- [63]
PGEA and the resultant stimuli-responsive drug/gene 图 7 乙酰胆碱酯酶在乙酰胆碱存在下药物递送途径
codelivery [62] Fig. 7 Acetylcholinesterase drug delivery route in the
[63]
presence of acetylcholine
4.2.3 酶响应
酶响应主要利用功能化修饰后的 MONs 在体内
通过酶引起酯键、肽键和酰胺键等的断裂驱动药物
释放。乙酰胆碱(ACh)是体内的一种神经递质,
LLOPIS-LORENTE 等 [63] 合成了一种金纳米修饰的
MONs(S3),用乙酰胆碱酯酶对材料表面功能化,
乙酰胆碱酯酶会监测体内过度表达的乙酰胆碱,乙
酰胆碱被酶水解产生胆碱和乙酸将导致局部 pH 降
低,当到达乙酰胆碱浓度高的区域时,如帕金森病
患者的神经肌肉接头或纹状体时,桥联基团被质子
化引发材料的裂解,药物会在特定的部位释放,实 TESPTS 为 1,4-双(三乙氧基硅丙基)四硫烷
图 8 基于 PMOs 的智能肿瘤靶向成像和药物传递系统的
现酶响应(如图 7 所示)。
构建 [64]
4.3 肿瘤细胞靶向及成像 Fig. 8 The construction of the PMOs-based smart cancer
研究发现,PMOs 是可生物降解的,比 MSNs targeting imaging and drug delivery system [64]