Page 215 - 《精细化工》2023年第11期
P. 215
第 11 期 温俊宇,等: CuAl-LDO 活化过一硫酸盐降解罗丹明 B ·2527·
射峰,分别对应 CuAl-LDH 的(003)、(006)、(012)、 2.6 RhB 降解实验的影响因素
(015)、(018)和(1010)晶面 [17] ,结果表明,该 2.6.1 CuAl-LDO 投加量
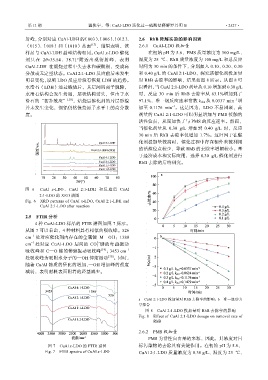
样品与 CuAl-LDH 晶型结构相同。CuAl x-LDO 催化 在初始 pH 为 5.6、PMS 质量浓度为 300 mg/L、
剂只在 2θ=35.54、38.71°附近出现衍射峰,表明 温度为 25 ℃、RhB 质量浓度为 100 mg/L 和总反应
CuAl-LDH 在煅烧过程中失去水和碳酸根,变成高 时间为 30 min 的条件下,分别加入 0.10、0.20、0.30
分散或无定型状态。CuAl 2:1-LDO 反应前后未发生 和 0.40 g/L 的 CuAl 2:1-LDO,探究该催化剂投加量
明显变化,说明 LDO 反应后没有恢复 LDH 的趋势。 对 RhB 去除率的影响,结果如图 8 所示。从图 8 可
水滑石(LDH)经过煅烧后,其层间阴离子脱除, 以看出,当 CuAl 2:1-LDO 剂量从 0.10 增加到 0.30 g/L
水滑石结构会发生坍塌,层状结构消失,但由于水 时,反应 30 min 后 RhB 去除率从 63.1%增加到了
–1
滑石的“拓扑效应” [18] ,焙烧后催化剂的片层形貌 97.1%,准一级反应速率常数 k obs 从 0.0337 min 增
–1
并未发生变化,铜铝仍然保持原子水平上的高分散 加至 0.1176 min 。这是因为,LDO 不易团聚,高
度。 剂量的 CuAl 2:1-LDO 可以明显增加与 PMS 接触的
活性位点,从而加快了与 PMS 的反应速率。然而,
当催化剂量从 0.30 g/L 增加到 0.40 g/L 时,反应
30 min 后 RhB 去除率仅增加 1.7%。这归因于在催
化剂投加量较高时,催化过程中存在额外未被利用
的活性位点较少,导致 RhB 的去除率增幅较小。基
于经济成本和实际应用,选择 0.30 g/L 催化剂进行
RhB 去除的后续研究。
图 6 CuAl x-LDO 、 CuAl 2:1-LDH 和 反应后 CuAl
2:1-LDO 的 XRD 谱图
Fig. 6 XRD patterns of CuAl x-LDO, CuAl 2:1-LDH and
CuAl 2:1-LDO after reaction
2.5 FTIR 分析
4 种 CuAl-LDO 样品的 FTIR 谱图如图 7 所示。
从图 7 可以看出,4 种材料具有相似的吸收峰。526
cm –1 处对应催化剂内存在的金属键 M—OH;1388
2–
–1
cm 处对应 CuAl-LDO 层间的 CO 3 键的弯曲振动
吸收峰和 C—O 键的伸缩振动吸收峰 [19] ;3453 cm –1
处吸收峰为吸附水分子的—OH 伸缩振动 [20] 。同时,
随着 Cu/Al 物质的量比的增加,—OH 增加峰的强度
减弱,表明材料表面附着的羟基减少。
a—CuAl 2:1-LDO 投加量对 RhB 去除率的影响;b—准一级动力
学拟合
图 8 CuAl 2:1-LDO 投加量对 RhB 去除率的影响
Fig. 8 Effect of CuAl 2:1-LDO dosage on removal rate of
RhB
2.6.2 PMS 投加量
PMS 为活性自由基的来源,因此,其浓度对目
图 7 CuAl x-LDO 的 FTIR 谱图 标污染物的去除具有关键作用。在初始 pH 为 5.6、
Fig. 7 FTIR spectra of CuAl x-LDO CuAl 2:1-LDO 质量浓度为 0.30 g/L、温度为 25 ℃、