Page 217 - 《精细化工》2023年第11期
P. 217
第 11 期 温俊宇,等: CuAl-LDO 活化过一硫酸盐降解罗丹明 B ·2529·
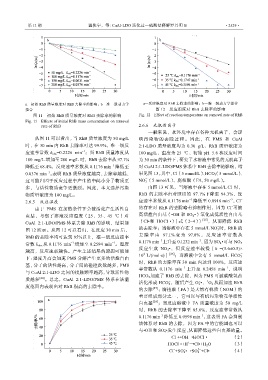
a—初始 RhB 质量浓度对 RhB 去除率的影响;b—准一级动力学 a—反应温度对 RhB 去除率的影响;b—准一级动力学拟合
拟合 图 12 反应温度对 RhB 去除率的影响
图 11 初始 RhB 质量浓度对 RhB 去除率的影响 Fig. 12 Effect of reaction temperature on removal rate of RhB
Fig. 11 Effects of initial RhB mass concentration on removal
rate of RhB 2.6.6 无机阴离子
一般来说,水环境中存在各种无机离子,会影
从图 11 可以看出,当 RhB 质量浓度为 50 mg/L 响污染物的去除过程。因此,在 PMS 和 CuAl
时,在 30 min 内 RhB 去除率可达 99.9%,准一级反 2:1-LDO 质量浓度均为 0.30 g/L、RhB 质量浓度为
–1
应速率常数 k obs =0.2226 min ;当 RhB 质量浓度从 100 mg/L、温度为 25 ℃、初始 pH=5.6 和反应时间
100 mg/L 增加至 200 mg/L 时,RhB 去除率从 97.1% 为 30 min 的条件下,研究了水溶液中常见的无机离子
–1
降低至 68.4%,反应速率常数从 0.1176 min 降低至 对 CuAl 2:1-LDO/PMS 体系中 RhB 去除率的影响,结
−
−
–1
0.0376 min 。表明 RhB 质量浓度越高,去除率越低, 果见图 13。其中,Cl(5 mmol/L)、HCO 3 (5 mmol/L)、
−
这可能归因于反应过程中产生的中间小分子物质更 NO 3 (5 mmol/L)、腐植酸(FA, 50 mg/L)。
−
多,与活性物质竞争更激烈。因此,本文选择污染 由图 13 可见,当溶液中存在 5 mmol/L Cl 时,
物质量浓度为 100 mg/L。 RhB 的去除率由对照组的 97.1%下降至 94.3%,反
–1
–1
2.6.5 反应温度 应速率常数从 0.1176 min 降低至 0.0916 min ,Cl −
−
由于 PMS 在加热条件下会被活化产生活性自 的存在对 RhB 的去除略有抑制作用,因为 Cl 可被
–
由基,考察了溶液反应温度(25、35、45 ℃)对 高活性自由基(•OH 和 SO 4 •)氧化成低活性自由基
−
CuAl 2:1-LDO/PMS 体系去除 RhB 的影响,结果如 (Cl•和 HOCl •)〔式(2~4)〕 [25] ,从而降低 RhB
−
图 12 所示。从图 12 可以看出,在反应 30 min 后, 的去除率;当溶液中存在 5 mmol/L NO 3 时,RhB 的
去除率由 97.1% 变为 97.8% ,反 应 速率常 数从
RhB 的去除率均可达到 95%以上,准一级反应速率
–1 –1 − −
–1
–1
常数 k obs 从 0.1176 min 增加至 0.2594 min 。温度 0.1176 min 上升至 0.1232 min ,因为 SO 4 •可与 NO 3
反应生成 NO 3 •,但反应速率较慢〔k =(5.6±0.5)×
越高,反应速率越快。产生上述结果的原因可能如
4
10 L/(mol·s)〕 [26] ;当溶液中含有 5 mmol/L HCO 3 −
下:温度升高会加速 PMS 分解产生更多的活性自由
时,RhB 的去除率在 30 min 内达到 100%,反应速
基,分子的活性越高,分子间的碰撞次数越多,PMS
–1
率常数从 0.1176 min –1 上升至 0.2458 min ,说明
与 CuAl 2:1-LDO 之间的接触频率越高,导致活性物 HCO 3 加速了 RhB 的去除,因为 PMS 可被碳酸氢盐
−
质越多 [24] 。总之,CuAl 2:1-LDO/PMS 体系在该温
−
1
−
活化形成 HCO 4 ,随后产生 O 2 •、 O 2 从而加速 RhB
度范围内表现出对 RhB 很高的去除率。
的去除 [27] ;腐植酸(FA)是天然有机质(NOM)的
重要组成部分之一,它可以与有机污染物竞争活性
自由基 [28] ;当反应溶液中 FA 质量浓度为 50 mg/L
时,RhB 的去除率下降至 85.6%,反应速率常数从
–1
–1
0.1176 min 降低至 0.0598 min ,这表明 FA 会抑制
该体系对 RhB 的去除,因为 FA 中的官能团也可以
–
与•OH 和 SO 4 •发生反应,从而降低这些自由基的量。
–
–
Cl +•OH→HOCl • (2)
–
+
HOCl •+H →Cl•+H 2 O (3)
–
–
2–
Cl +SO 4 •→SO 4 +Cl• (4)