Page 195 - 《精细化工》2023年第12期
P. 195
第 12 期 张露妍,等: γ-氨基丁酸/L-瓜氨酸增强白果分离蛋白凝胶性 ·2737·
由图 7 可以发现,非还原条件下,条带主要集 是分析蛋白二级结构变化的重要区域 [40] 。在 pH 7.0
中于 45.0~66.2 kDa 之间,说明其中的蛋白没有参与 时,两种氨基酸加入后,酰胺 A 的峰向较短的波数
凝胶基质的形成。未添加氨基酸时,pH 5.0 和 pH 6.0 轻微移动,可能是由于 GABA、L-Cit 与蛋白之间形
的条带强度明显高于 pH 7.0,这也说明在 pH 7.0 时 成了氢键 [41] 。GABA 的加入在 pH 7.0 时,凝胶的酰
形成的凝胶结构更紧密。氨基酸可以通过与蛋白分 胺Ⅰ移至更长的波数,表明蛋白 α-螺旋结构增加,
子的静电作用影响蛋白分子的构象,进而影响凝胶 而在 pH 5.0 和 pH 6.0 条件下影响不显著。L-Cit 的
结构 [36] 。GABA 的加入使 3 种 pH 条件下的条带均 加入在 3 种 pH 条件下都使凝胶的酰胺Ⅰ移至更长
淡化,说明 GABA 抑制了蛋白的浸出。WANG 等 [12] 的波数,且在 pH 7.0 时效果最显著,说明 L-Cit 比
也发现,GABA 对乳清蛋白的浸出性有抑制作用。 GABA 更能促进 α-螺旋结构增加。
L-Cit 的加入在 pH 6.0 和 pH 7.0 条件下的条带有所 2.7 GABA/L-Cit 对白果分离蛋白凝胶微观结构的
淡化,而在 pH 5.0 时变化不显著。这与蛋白浸出性 影响
(图 6)的结果一致。还原条件下,45.0~66.2 kDa 为了进一步探究凝胶的质地,采用环境扫描电
之间的条带消失,表明这部分蛋白聚合物通过二硫 子显微镜观察 GABA、L-Cit 加入白果分离蛋白所成
键交联 [37] 。 凝胶的微观结构,结果如图 9 所示。
2.6 GABA/L-Cit 加入白果分离蛋白所成凝胶的
FTIR 分析
采用 FTIR 来检测蛋白分子在 GABA、L-Cit 作
用下高级结构的变化,结果如图 8 所示。
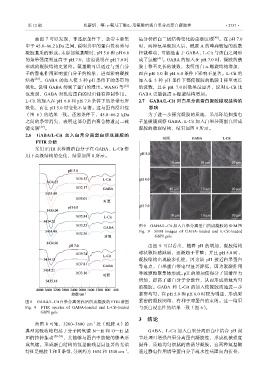
图 9 GABA/L-Cit 加入白果分离蛋白所成凝胶的 SEM 图
Fig. 9 SEM images of GABA-loaded and L-Cit-loaded
GSPI gels
由图 9 可以看出,随着 pH 的增加,凝胶结构
球状颗粒感减弱,逐渐趋于平整;并且 pH 5.0 时,
凝胶结构出现较多孔缝,因为该 pH 接近白果蛋白
等电点,白果蛋白带电量显著降低,因为絮凝作用
导致颗粒聚集体形成。pH 的增加使得分子间排斥力
增加,提高了蛋白分子分散性,从而形成质地均匀
的凝胶。GABA 和 L-Cit 的加入使凝胶质地进一步
紧密均匀,在 pH 5.0 和 pH 6.0 时较为明显,形成更
图 8 GABA/L-Cit 白果分离蛋白后所成凝胶的 FTIR 谱图 紧密的凝胶网络,有利于对蛋白的束缚。这一结果
Fig. 8 FTIR spectra of GABA-loaded and L-Cit-loaded 与蛋白浸出性的结果一致(图 6)。
GSPI gels
3 结论
–1
由图 8 可知,3200~3600 cm 处(酰胺 A)的
典型宽吸收峰归属于分子间氢键 N—H 和 O—H 基 GABA、L-Cit 加入白果分离蛋白中结合 pH 调
团的拉伸振动 [38-39] ,其能够与蛋白中肽键的羰基形 节处理可增强白果分离蛋白凝胶性,形成机械强度
成氢键。形成蛋白结构的氨基酸残基最显著的光谱 提升、质地均匀细腻的热诱导凝胶。这两种氨基酸
−1
特征是酰胺Ⅰ和Ⅱ条带,分别约为 1654 和 1540 cm , 通过静电作用诱导蛋白分子疏水性基团向内折叠,