Page 192 - 《精细化工》2023年第12期
P. 192
·2734· 精细化工 FINE CHEMICALS 第 40 卷
影响,结果见图 1。由图 1 可以发现,由于 pH 5.0 降低了表面疏水性 [26] 。
接近白果分离蛋白的等电点(pI 4.4),白果分离蛋
白的溶解度在 pH 5.0 时最低,在 pH 7.0 时最高。pH
5.0 样品含有最少的电荷,这削弱了静电排斥并导致
蛋白颗粒聚集 [21] 。pH 7.0 距离等电点最远,静电排
斥作用最强,进而溶解度最高。GABA 的加入轻微
地提高了白果分离蛋白的溶解度(pH 7.0 除外),
这与之前报道 GABA 能提高乳清蛋白和大豆蛋白
溶解度的研究结果类似 [11,14] 。但是在 pH 7.0 时略有
降低,可能是由于 GABA 等电点在 7.2 左右 [22] ,而
在 pH 7.0 时,GABA 呈中性,降低了与蛋白的静
电排斥作用。L-Cit 在 3 种 pH 下均能轻微提高白果
分离蛋白的溶解度,在其 pI 5.9 时则提升幅度最小。
总体上这两种氨基酸对白果分离蛋白的溶解度提
高程度不大,而 pH 的增加则能大幅度地提高蛋白
溶解度。
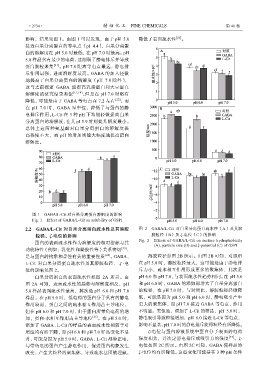
图 1 GABA/L-Cit 对白果分离蛋白溶解度的影响
Fig. 1 Effect of GABA/L-Cit on solubility of GSPI
2.2 GABA/L-Cit 对白果分离蛋白疏水性及其溶胶 图 2 GABA/L-Cit 对白果分离蛋白疏水性(A)及其溶
粒径、ζ-电位的影响 胶粒径(B)及 ζ-电位(C)的影响
Fig. 2 Effects of GABA/L-Cit on surface hydrophobicity
蛋白的表面疏水性作为溶解度的相对指标与其 (A), particle size (B) and ζ-potential (C) of GSPI
功能特性(例如:乳化性和凝胶性等)关系密切 [23] ,
是与蛋白的构象和柔性有关的重要性质 [24] 。GABA、 溶胶粒径如图 2B 所示。由图 2B 可知,对照组
L-Cit 对白果分离蛋白疏水性及其溶胶粒径、ζ-电 在 pH 5.0 时,溶胶粒径最大,这可能是由于静电排
位的影响见图 2。 斥力小,疏水相互作用形成更多的聚集体,其次是
白果分离蛋白的表面疏水性如图 2A 所示。由 pH 6.0 和 pH 7.0,与表面疏水性趋势相同。在 pH 5.0
图 2A 可知,表面疏水性的趋势与溶解度相反,pH 和 pH 6.0 时,GABA 的添加都增大了白果分离蛋白
5.0 样品表面疏水性最高,其次是 pH 6.0 和 pH 7.0 的粒径,在 pH 7.0 时,与对照比,溶胶粒径轻微降
样品。在 pH 5.0 时,低电荷的蛋白分子具有的静电 低,可能是因为 pH 5.0 和 pH 6.0 时,静电吸引产生
作用较弱,蛋白之间的疏水相互作用占主导地位, 更大的聚集体,而 pH 7.0 接近 GABA 等电点,作用
但在 pH 6.0 和 pH 7.0 时,由于蛋白所带负电荷的增 不明显。类似地,添加了 L-Cit 的样品,pH 5.0 时,
加,蛋白-水相互作用占主导地位 [25] 。在 pH 5.0 时, 静电吸引导致粒径增加,pH 6.0 接近 L-Cit 等电点,
添加了 GABA、L-Cit 的样品的表面疏水性相较于对 影响不显著,pH 7.0 时的静电排斥使得粒径有所降低。
照组均有所下降,而 pH 6.0 和 pH 7.0 样品变化不显 ζ-电位与蛋白溶液系统中蛋白分子表面的电荷
著,可能是因为 pH 5.0 时,GABA、L-Cit 都带正电, 强度相关,并决定静电排斥或吸引力的强度 [27] 。ζ-
与带负电的蛋白产生静电作用,促进蛋白构象发生 电位如图 2C 所示。由图 2C 可知,GABA 使样品的
改变,产生大粒径的聚集体,导致疏水基团被埋藏, ζ-电位均有所降低。这些变化可能是在 3 种 pH 条件