Page 172 - 《精细化工》2023年第6期
P. 172
·1322· 精细化工 FINE CHEMICALS 第 40 卷
3+
光度也大幅度降低。鉴于这一实验结果,可基于 Fe 3+ 果见图 6。由图 6 可知,向 Fe -OPD 显色液中加入
和 OPD 显色液建立一种比色法检测 NaHS 的方法。 NaHS,混合液的亮黄色快速褪去,溶液 450 nm 处
吸光度和 570 nm 处荧光强度在 3 min 左右趋于稳
定。但是,当时间超过 2 h 后混合液颜色进一步褪
去,吸光度降低,荧光逐渐减弱。因此,考虑到吸光
度和荧光的稳定性,反应液混合 5 min 后进行紫外-
可见吸收光谱检测,在混合 8 min 后进行荧光检测。
注:NaHS 浓度从左到右依次为 0、20、70、150、300 μmol/L
3+
图 3 不同浓度的 NaHS 和 Fe -OPD 显色体系反应后的
溶液颜色和 UV-Vis 吸收光谱
Fig. 3 Solution color and UV-Vis absorption spectra of
3+
Fe -OPD chromogenic system in the presence of
NaHS with different concentrations
3+
3+
图 4 为 Fe -OPD 显色体系检测 NaHS 的原理 图 5 在不同 pH 的缓冲液中 OPD(1.0 mmol/L)与 Fe
3+
图。OPD 可被 Fe 氧化形成黄色产物 oxOPD,从而 (1.0 mmol/L)混合(黑线)以及向该混合液加入
3+
3+
使 Fe -OPD 混合液呈现黄色;当向 Fe -OPD 显色 100 μmol/L NaHS(红线)后的溶液颜色和 UV-Vis
吸收光谱
2+
3+
液中加入 NaHS,NaHS 将 Fe 还原生成 Fe ,Fe 2+ Fig. 5 Solution color and UV-Vis adsorption spectra of 1.0
3+
3+
不能氧化 OPD 形成黄色 oxOPD,从而导致 Fe -OPD mmol/L OPD and 1.0 mmol/L Fe in the absence
混合液的黄色褪去,这就构成了比色法检测 NaHS (black line) and the presence of 100 μmol/L NaHS
(red line)
的基础。
3+
图 4 基于 Fe -OPD 显色体系可视法测定硫化物的原理
3+
Fig. 4 Proposed scheme of Fe -OPD chromogenic system
for colormetric detection of NaHS
2.3 实验条件的优化
为了提高实验的灵敏度和选择性,通过紫外-
可见吸收光谱和混合液颜色考察了 pH 对显色体系
3+
的影响。图 5 为在 pH 1~8 的缓冲液中,Fe -OPD
3+
显色体系与 NaHS 的反应情况。考虑到 Fe 在碱性
条件下生成氢氧化铁沉淀,所以选用 pH 1~8 的缓冲
液。从图 5 可看出,加入 NaHS 前,以 pH 1~4 缓冲
3+
液为底液,Fe -OPD 显色液均呈现深黄色,在
450 nm 处吸光度最大;而只有在 pH 4 缓冲液中,
3+
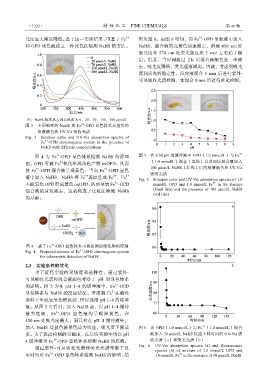
加入 NaHS 后显色液褪色最为明显,吸光度下降最 图 6 向 OPD(1.0 mmol/L)与 Fe (1.0 mmol/L)混合
多。为了提高检测的灵敏度,在后续实验中均以 pH 液加入 30 μmol/L NaHS 反应不同时间的 UV-Vis 吸
3+
4 缓冲液为 Fe -OPD 显色体系检测 NaHS 的底液。 收光谱(a)和荧光光谱(b)
Fig. 6 UV-Vis absorption spectra (a) and fluorescence
通过紫外-可见吸收光谱和荧光光谱考察了反 spectra (b) of mixture of 1.0 mmol/L OPD and
3+
3+
应时间对 Fe -OPD 显色体系检测 NaHS 的影响,结 1.0 mmol/L Fe in the presence of 30 μmol/L NaHS