Page 186 - 201901
P. 186
·172· 精细化工 FINE CHEMICALS 第 36 卷
随着 n(ASA)/n(SPI-NH 2 )的增加,上述吸收峰的强度 吸收峰。随着 n(ASA)/n(SPI-NH 2 )的增加,在 210 nm
显著增强,这一现象进一步证实了酰化反应成功进 处的吸收峰发生红移,且 279 nm 处的吸收峰强度呈
行,在 SPI 骨架上生成新的酰胺键(—NH—CO—), 增加趋势。上述现象的原因可归结如下:酰化反应
并且引入大量的烷基链。 的成功进行在 SPI 分子骨架上生成新的酰胺键及引
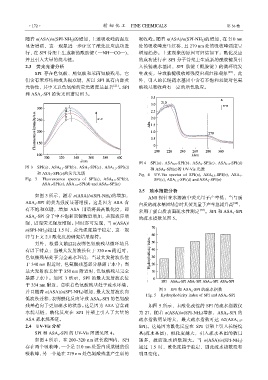
2.3 荧光光谱分析 入长链疏水基团,SPI 肽键(酰胺键)的微环境发
SPI 存在色氨酸、酪氨酸和苯丙氨酸残基,它 生改变,导致肽键吸收峰强度出现红移现象 [23] ,此
们含有苯环结构或共轭双键,所以 SPI 具有内源荧 外,引入的长链疏水基团中含有不饱和双键对色氨
光特性,其中又以色氨酸的荧光强度最显著 [21] 。SPI 酸残基吸收峰有一定的增色效应。
和 ASA x -SPI 的荧光图谱见图 3。
图 4 SPI(a)、ASA 0.5 -SPI(b)、ASA 1 -SPI(c)、ASA 1.5 -SPI(d)
图 3 SPI(a)、ASA 0.5 -SPI(b)、ASA 1 -SPI(c)、ASA 1.5 -SPI(d) 和 ASA 2 -SPI(e)的 UV-Vis 光谱
和 ASA 2 -SPI(e)的荧光光谱 Fig. 4 UV-Vis spectra of SPI(a), ASA 0.5 -SPI(b), ASA 1 -
Fig. 3 Fluorescence spectra of SPI(a), ASA 0.5 -SPI(b), SPI(c), ASA 1.5 -SPI(d) and ASA 2 -SPI(e)
ASA 1 -SPI(c), ASA 1.5 -SPI(d) and ASA 2 -SPI(e)
2.5 疏水指数分析
如图 3 所示,随着 n(ASA)/n(SPI-NH 2 )的增加, ANS 探针在水溶液中荧光量子产率低,当与蛋
ASA x -SPI 的荧光强度显著增强。这是因为 ASA 含 白质的疏水基团结合时其荧光量子产率急剧升高 [24] ,
有不饱和双键,增加 ASA 用量将提高酰化度,即 [25]
常用于蛋白质表面疏水性测定 。SPI 和 ASA x -SPI
ASA x -SPI 分子中不饱和双键数量增加,共轭效应增
的疏水指数见图 5。
强,进而荧光强度增强。同时亦可发现,当 n(ASA)/
n(SPI-NH 2 )超过 1.5 时,荧光强度趋于稳定,这一规
律与上文 2.1 酰化度的研究结果相符。
另外,根据文献[22]表明色氨酸残基微环境具
有以下特点:当最大发射波长位于 330 nm 附近时,
色氨酸残基处于完全疏水环境;当最大发射波长位
于 340 nm 附近时,色氨酸残基部分暴露于水中;当
最大发射波长位于 350 nm 附近时,色氨酸残基完全
暴露于水中。如图 3 所示,SPI 的最大发射波长位
于 334 nm 附近,意味着色氨酸残基处于疏水环境,
图 5 SPI 和 ASA x -SPI 的疏水指数
并且随着 n(ASA)/n(SPI-NH 2 )增加,最大发射波长向
Fig. 5 Hydrophobicity index of SPI and ASA x -SPI
低波长迁移,表明酰化反应导致 ASA x -SPI 的色氨酸
残基趋向于更加疏水的状态。这是因为 ASA 富含疏 如图 5 所示,未酰化改性的 SPI 的疏水指数仅
水烷基链,酰化反应在 SPI 骨架上引入了大量的 为 27,随着 n(ASA)/n(SPI-NH 2 )增加,ASA x -SPI 的
ASA 疏水烷基链。 疏水指数明显增大,最大疏水指数可达 62(ASA 1.5 -
2.4 UV-Vis 分析 SPI)。这是因为酰化反应在 SPI 骨架上引入长链烷
SPI 和 ASA n -SPI 的 UV-Vis 图谱见图 4。 基(疏水基团),酰化度越大,引入疏水基团的数目
如图 4 所示,在 200~320 nm 波长范围内,SPI 越多,故而疏水指数越大。当 n(ASA)/n(SPI-NH 2 )
存在两个吸收峰,一个是 210 nm 处蛋白质肽键的强 超过 1.5 时,酰化度趋于稳定,因此疏水指数没有
吸收峰,另一个是在 279 nm 处色氨酸残基产生弱的 明显变化。