Page 99 - 精细化工2019年第12期
P. 99
第 12 期 黄秋容,等: 肉桂内生菌 Sphingomonas sp. Z45 生物转化肉桂醇生成天然 2-苯乙醇 ·2427·
GC 条件:色谱柱为 Rxi-5Sil MS 熔融石英毛细 2.2 菌体生物量和 OD 600 标准曲线的测定
管柱(30 m×0.25 mm×0.25 µm),载气为高纯氦气。 菌体浓度直接影响转化效果。以菌体干重作为
柱前压 100 kPa,分流比 1∶20,进样量 0.2 µL,进 生物量测定的指标。转化结束后,取一定量转化液,
样口温度 250 ℃,接口温度 260 ℃。二阶程序升温, 用蒸馏水稀释成不同倍数后,测定菌悬液在 600 nm
柱初温为 100 ℃,以 15 ℃/min 升至 200 ℃,再以 处的吸光值 [28] 。离心后倾去上清液,洗涤两次,
20 ℃/min 升至 250 ℃。MS 条件为 EI 离子源,电子 105 ℃烘干至恒重,根据 OD 600 与菌体干重(g/L)
能量 70 eV,电子倍增器电压 1.5 kV,全扫描方式。 标准曲线求出生物量,结果见图 2。
2 结果与讨论
2.1 产 2-苯乙醇菌株的筛选
将分离纯化所得的肉桂内生菌进行摇瓶培养,
转化液经高效液相色谱分析测定。筛选出可转化肉
桂醇为 2-PE 的菌株共 4 株,其中菌株 Z45 具有较高
的转化肉桂醇生成 2-PE 的能力。经广西南宁国拓生
物技术有限公司对其进行 16S rDNA 基因序列扩增
并测序,鉴定菌株 Z45 为鞘氨醇单胞菌,并命名为
Sphingomonas sp. Z45。其转化肉桂醇生成 2-PE 的
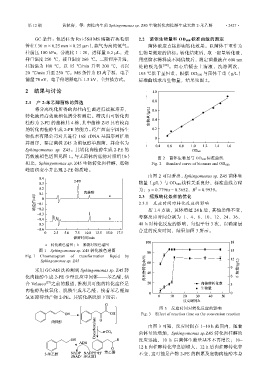
高效液相色谱图见图 1。与无菌体的底物对照组(b) 图 2 菌体生物量与 OD 600 标准曲线
相比,Sphingomonas sp. Z45 生物转化肉桂醇,底物 Fig. 2 Standard curve of biomass and OD 600
峰面积变小并出现 2-PE 物质峰。
由图 2 可以看出,Sphingomonas sp. Z45 菌体生
物量(g/L)与 OD 600 线性关系良好,标准曲线方程
2
为:y = 0.7796x-0.3652,R = 0.9939。
2.3 摇瓶转化条件的优化
2.3.1 反应时间对转化反应的影响
按 1.4 方法,菌体增殖 24 h 后,其他条件不变,
考察反应时间分别为 1、4、8、10、12、24、36、
48 h 对转化反应的影响,每组平行 3 次,以确定最
合适的反应时间,结果如图 3 所示。
a—转化液色谱图;b—底物对照色谱图
图 1 Sphingomonas sp. Z45 转化液色谱图
Fig. 1 Chromatogram of transformation liquid by
Sphingomonas sp. Z45
采用 GC-MS 法检测到 Sphingomonas sp. Z45 转
化肉桂醇生成 2-PE 少量反应中间体——苯乙醛,结
合 Velasco [27] 之前的报道,推测其可能的转化途径是
肉桂醇先被氧化、脱羧生成苯乙醛,接着苯乙醛加
氢还原得到产物 2-PE。其转化路线如下所示:
图 3 反应时间对转化反应的影响
Fig. 3 Effect of reaction time on the conversion reaction
由图 3 可知,反应时间在 1~10 h 范围内,随着
菌体量的增加,Sphingomonas sp.Z45 转化肉桂醇的
反应迅速,10 h 后菌体生物量基本不再增长;10~
12 h 肉桂醇转化率急剧增大,12 h 后肉桂醇转化率
不变,这可能是产物 2-PE 的积累及底物肉桂醇本身