Page 146 - 精细化工2020年第2期
P. 146
·348· 精细化工 FINE CHEMICALS 第 37 卷
CAR/PDMS 萃取头萃取 40 min,然后将萃取头置于 1.2.6 定性和定量
GC 进样口中,250 ℃下解析 5 min 进行 GC-MS 分析。 定性:采用 NIST 11 谱库检索(化合物匹配度
1.2.3 多次顶空固相微萃取 大于 80)、标准品比对定性。
多次顶空固相微萃取(MHS-SPME)是基于样 定量:采用外标曲线校准,取 100 μL 稀释混标
品中的分析物含量会随提取的次数呈指数递减,通 溶液于顶空瓶中,然后采用 1.2.3 节条件进行
过对相同样品进行 3~4 次连续提取,再通过公式(1) MHS-SPME 分析。通过将总峰面积(A T )与相应的
计算出目标化合物的总面积: 质量(ng)作图来确定目标化合物的校准曲线。
i i 1 A 最低浓度混标的第一次萃取中,信噪比等于 3
A T A N A 1 N 1 (1) 时质量浓度为该物质的检出限(LOD)。
N 1 N 0 1
回收率的计算 [18] :配制一定浓度的标准溶液
式中:A T 是目标化合物色谱峰的总面积;A 1 是该化
C o ,准确量取与样品中目标化合物含量相同的溶液
合物第一次萃取时色谱峰的面积;β(常数)可以从
于顶空瓶中,采用 1.2.3 节的方法进行实验操作,计
线性回归分析方程(2)计算:
算出总峰面积 A T ,将其带入相应化合物的标准曲线
lnA lnA i 1 ln (2) 中,计算得到化合物的含量(ng),进一步计算出实
i 1
式中:A i 是在第 i 次提取时的峰面积;lnA i 是第 i 验浓度 C e ,回收率/%=C e /C o ×100。
次峰面积的对数值;(i-1)是提取次数 i 减 1;β 是 2 结果与讨论
通过 lnA i -(i–1)线性回归方程的斜率值(lnβ)计算
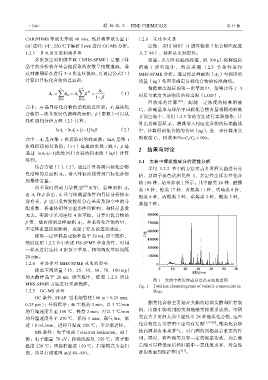
得到。 2.1 大曲中挥发性成分的定性分析
结合方程(1)、(2),通过计算得到目标化合物 采用 1.2.2 节中的方法对古井贡酒大曲进行分
色谱峰的总面积 A T ,带入外标曲线得到目标化合物 析,总离子流色谱图见图 1,共定性出挥发性化合
的最终含量。 物 108 种,结果如表 1 所示。其中酯类 28 种,醛酮
由萃取时的动力学模型 [10]
类 18 种,醇类 17 种,含氮类 11 种,呋喃类 8 种,
可知,总峰面积 A T
由 A 1 和 β 求出,A 1 只与检测器条件和目标分析物本 酚类 8 种,内酯类 3 种,萜烯类 3 种,酸类 5 种,
身有关,β 也只受挥发性组分在基质及顶空中的分
其他 7 种。
配系数、各相体积等实验条件所影响,和样品基质
无关。实验中采用连续 4 次萃取,计算出化合物的
β 值,继而得到总峰面积 A T ,并求得化合物的量,
不受体系基质的影响,克服了样品的基质效应。
称取一定量样品或标准品于 20 mL 顶空瓶中,
然后按照 1.2.2 节中所述 HS-SPME 萃取条件,对同
一样品进行连续 4 次顶空萃取,相邻两次萃取间隔
20 min。
1.2.4 样品量对 MHS-SPME 效果的影响
称取不同质量(15、25、35、50、70、100 mg)
的大曲样品于 20 mL 顶空瓶中,按照 1.2.3 所述
图 1 大曲中挥发性成分总离子流色谱图
MHS-SPME 方法进行实验操作。 Fig. 1 Total ion chromatograms of volatile components in
1.2.5 GC-MS 分析 Daqu
GC 条件:FFAP 型毛细管柱(60 m × 0.25 mm,
0.25 μm);升温程序:40 ℃保持 3 min,以 3 ℃/min 酯类化合物主要是在大曲的培菌发酵和贮存期
的升温速度升至 150 ℃,保持 2 min;再以 7 ℃/min 间,由微生物利用醇类和羧酸类物质形成的。本研
的升温速度升至 230 ℃,保持 5 min;载气 He,流 究在古井贡酒大曲中定性出 28 种酯类化合物,这些
速 1.0 mL/min,进样口温度 250 ℃;不分流进样。 化合物在古井贡酒中也均有发现 [1,19-20] 。酯类化合物
MS 条件:电子电离(electron ionization,EI) 使白酒具有水果香气,对白酒的风格起着重要的作
源;电子能量 70 eV;传输线温度 250 ℃;离子源 用。同时,有些酯类具有一定的健康功效,如乙酸
温度 230 ℃;四极杆温度 150 ℃;扫描模式为全扫 乙酯可以降低血清和肝脏中一氧化氮水平,对急性
描,质量扫描范围 m/Z 45~450。 肝损伤起到保护作用 [21] 。