Page 141 - 《精细化工》2020年第6期
P. 141
第 6 期 杜星芳,等: 菜芙蓉多糖的表征与生物活性 ·1207·
Biotium 公司专利产品)的 10 g/L 琼脂糖凝胶电泳 薄层层析鉴定黄蜀葵根茎多糖是由半乳糖、阿拉伯
[9]
点样孔中,工作电压 95 V,在 1×TAE 电泳缓冲液 糖、鼠李糖构成。PAN 等 研究结果显示,黄蜀葵根
(T:Tri; A:NaAc; E:EDTA,40 mmol/L Tris-20 mmol/L 茎多糖是由甘露糖、葡萄糖醛酸、鼠李糖、葡萄糖、
[3]
NaAc-1 mmol/L EDTA)中电泳 40 min 后,凝胶成 半乳糖、阿拉伯糖组成。ZHENG 等 研究发现,采
像仪成像,观察。 自安徽省的菜芙蓉花多糖中单糖组分为葡萄糖、甘
1.2.6 AMP 对 HepG2 细胞增殖的抑制作用 露糖、半乳糖、岩藻糖。由此可见,菜芙蓉植株不同
4
取对数生长期 HepG2 细胞,以 5×10 个/mL 的 部位及不同产地 AMP 中的单糖组成不同,可能产生
浓度接种到 96 孔板,每孔 100 μL,37 ℃、5% CO 2 、 不同的生物学活性。
DMEM 培养基(含有体积分数为 10%的胎牛血清,
体积分数为 1%青霉素-链霉素混合液)中培养,24 h
后,吸去培养基,PBS 清洗 2 遍,分别加入含有不
同质量浓度多糖的细胞培养基,继续培养 24 h 后吸
去培养基,每孔加入 80 μL DMEM 培养基及 20 μL 5 g/L
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)
混匀,继续培养 4 h。弃去上清,每孔加入 150 μL
DMSO 溶液,避光振荡 20 min,使蓝色甲瓒结晶充
分溶解混匀,酶标仪于 570 nm 处测定吸光值(A)。
以无多糖培养基细胞作为空白对照,5-氟尿嘧啶
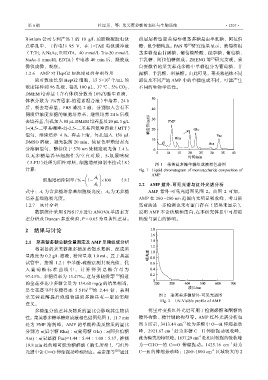
(5-FU)处理为阳性对照,细胞增殖抑制率按式(8) 图 1 菜芙蓉多糖单糖组成液相色谱图
计算: Fig. 1 Liquid chromatogram of monosaccharide composition of
A AMP
细胞增殖抑制率 / % 1 1 100 (8)
A 0 2.2 AMP 紫外-可见光谱与红外光谱分析
式中:A 1 为含多糖培养基细胞吸光度;A 0 为无多糖 AMP 紫外-可见光谱图见图 2。由图 2 可知,
培养基细胞吸光度。 AMP 在 260 ~280 nm 范围内无明显吸收峰,考马斯
1.2.7 统计分析 亮蓝法进一步检测也未有蛋白存在(结果未显示),
数据统计采用 SPSS17.0 进行 ANOVA 单因素方 说明 AMP 不含核酸和蛋白,在本研究体系中可排除
差分析及 Duncan 多重检验,P < 0.05 为显著性差异。 核酸与蛋白的影响。
2 结果与讨论
2.1 菜芙蓉多糖总糖含量测定及 AMP 单糖组成分析
将制备的菜芙蓉粗多糖加蒸馏水复溶,配成质
量浓度为 0.2 g/L 溶液,精密量取 1.0 mL,置于具塞
试管中,按照 1.2.1 中苯酚-硫酸法测其吸光值,代
入 葡萄糖 标准 曲线中 ,计 算得到 总糖 含量 为
97.43%,多糖得率为 13.47%。这与张晓娇等 [18] 报道
的金花葵花中多糖含量为 134.60 mg/g 的结果相当,
是金花葵茎叶多糖得率 5.51% [19] 的 2.44 倍,表明
菜芙蓉花醇提后残留物提取多糖具有一定的实际 图 2 菜芙蓉多糖紫外-可见光谱图
Fig. 2 UV-Visible profile of AMP
意义。
多糖组分的差异及物质的量比会影响其生物活 傅里叶变换红外光谱可用于检测醛糖和酮糖的
性。菜芙蓉多糖单糖组成液相色谱图见图 1,11.7 min 糖环构象、糖苷键的构型等。AMP 红外光谱分析如
–1
处为 PMP 溶剂峰,AMP 的单糖种类及物质的量比 图 3 所示,3413.44 cm 处为多糖中 O—H 伸缩振动
–1
分别为 n(鼠李糖 Rha)∶n(葡萄糖 Glu)∶n(阿拉伯糖 峰,2921.67 cm 处为多糖 C—H 伸缩振动吸收峰,
–1
Ara)∶n(岩藻糖 Fuc)=1.44∶5.44∶1.00∶5.37,推测 此为糖类的特征峰。1637.29 cm 处相对较强的吸收峰
–1
19.8 min 处的峰可能为糖醛酸(箭头所指),与红外 为—CHO—的 C==O 伸缩振动。1425.16 cm 处为
–1
光谱中含 C==O 伸缩振动峰相对应。高素莲等 [20] 通过 C—H 的伸缩振动峰;1200~1000 cm 区域较大的 2