Page 173 - 《精细化工》2021年第11期
P. 173
第 11 期 黄 煜,等: HZSM-5 固载离子液体催化合成烷基糖苷及其动力学 ·2319·
dc A (kk )c (8) 30.012 kJ/mol 。正 逆反应指前 因子分别为 : k 0 =
k c
2
–1
+
–1
2
–
dt A A,0 8.54×10 min ;k′ 0 =3.11×10 min 。将 E a 、E a 、k 0、
式(4)~(8)中:c A 为 t 时刻葡萄糖的浓度,mol/L; k′ 0 代入式(7)与(12),联立得动力学方程:
c A,0 为葡萄糖的初始浓度,mol/L;c B 为 t 时刻 B 结 10
3
构的浓度,mol/L;c E 为 t 时刻 E 结构的浓度,mol/L; r dC A / dt 8.54 10 exp 2 28.101 RT c A 3.11
+
c H+ 为 t 时刻 H 的浓度,mol/L;c ROH 为 t 时刻脂肪醇
10 exp 30.012 10 / R( 2 3 Tc E
)
即辛醇的浓度,mol/L;t 为反应时间,min。
2.5.3 动力学模型参数的求解
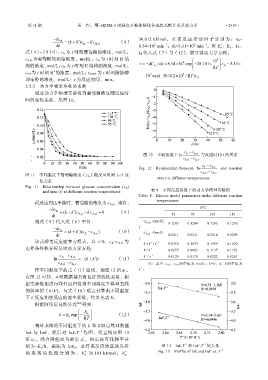
通过动力学模型实验得到葡萄糖浓度随反应时
间的变化关系,见图 11。
c c
图 12 不同温度下 ln A A,e 与反应时间 t 的关系
c A,0 c A,e
c c
Fig. 12 Relationship between ln A A,e and reaction
c c
图 11 不同温度下葡萄糖浓度(c A )随反应时间(t)变 A,0 A,e
time t at different temperatures
化关系
Fig. 11 Relationship between glucose concentration (c A )
and time (t) at different reaction temperatures 表 8 不同反应温度下的动力学模型参数值
Table 8 Kinetic model parameters under different reaction
设反应到达平衡时,葡萄糖的浓度为 c A,e,则有: temperatures
dc A (kk )c k c 0 (9) θ/℃
dt A,e A,0 85 95 105 115
将式(9)代入式(8)中得: c A,0 /(mol/L 0.1283 0.1284 0.1285 0.1270
dc A (kk )(c c ) (10) ) c
dt A A,e ) A,e /(mol/L 0.0211 0.0211 0.0210 0.0209
该式即为反应速率方程式,以 t=0、c A =c A,0 为 k k / s 0.0784 0.1033 0.1359 0.1620
–1
边界条件积分得反应动力学方程: k / s 0.0655 0.0863 0.1137 0.1353
–1
c c –1
ln A A,e (kk )t (11) k / s 0.0129 0.0170 0.0222 0.0267
c c
A,0 A,e 注:表中 c A,0、c A,e 的单位为 mol/L;k+k'、k、k'的单位为
–1
作不同温度下的式(11)曲线,如图 12 所示。 s 。
由图 12 可知,4 组数据都具有良好的线性关系,根
据实验数据进行线性回归得到不同温度下模型直线
的斜率值(k+k′),与式(10)联立计算出不同温度
下正反应和逆反应的速率常数,结果见表 8。
根据阿伦尼乌斯公式 [46] 得到:
k k 0 exp E a (12)
RT
将所求得的不同温度下的 k 和 k'取自然对数值
lnk 与 lnk′,然后对 lnk-T –1 作图,得直线如图 13
所示。结合阿伦尼乌斯公式,得出该直线斜率分
–1
–1
别为–E a /R,截距为 lnk 0 ,求得该反应的正逆反应 图 13 lnk-T 和 lnk′-T 的关系
–
+
的 表 观 活 化 能分别为 : E a =28.101 kJ/mol ; E a = Fig. 13 Profile of lnk and lnk′ vs. T –1