Page 141 - 《精细化工》2020年第2期
P. 141
第 2 期 刘玲玲,等: 林生茜草果实花青素纯化及稳定性分析 ·343·
吸附率(Q)和解吸率(D)及得率(F): 最大吸收峰。
( V V )
Q /% 0 0 e e 10 0 (2)
V 0
0
V
D /% 1 1 100 (3)
( 0 V 0 e V e )
V
F /% 1 1 100 (4)
V 0
0
式中: 为吸附前花青素的质量浓度,g/L;V 为
0
0
吸附前花青素溶液的体积,L; 为吸附后花青素
e
的质量浓度,g/L;V 为吸附后溶液的体积,L; 1
e
为解吸后花青素的质量浓度,g/L;V 为解吸后花青
1
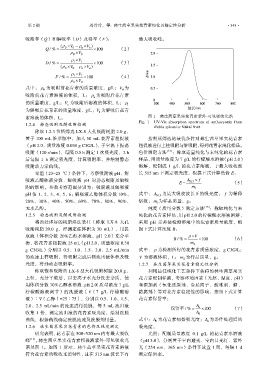
素溶液的体积,L。 图 1 林生茜草果实花青素紫外-可见吸收光谱
Fig. 1 UV-Vis absorption spectrum of anthocyanin from
1.2.4 静态吸附及解吸附检测
Rubia sylvatica Nakai fruit
称取 1.2.3 节所筛选 LX-8 大孔吸附树脂 2.0 g,
置于 100 mL 锥形瓶中,加入 50 mL 花青素粗提液 按照所筛选的最优条件对林生茜草果实花青素
(pH 2.0,质量浓度 0.038 g C3G/L),于室温下振荡 粗提液进行上柱吸附与解吸附,得到花青素纯化样品。
吸附(120 r/min),每隔 0.5 h 测定 1 次吸光度,2 h 色价测定方法 [14] :称取适量纯化与未纯化的花青素
后每隔 1 h 测定吸光度,计算吸附率,并绘制静态 样品,用质量浓度为 7 g/L 的柠檬酸水溶液(pH 2.0)
吸附动力学曲线。 溶解,配制成 1 g/L 的花青素溶液,于最大吸收波
室温(23~25 ℃)条件下,考察吸附液 pH、解 长 515 nm 下测定吸光度,根据下式计算色价 E:
吸液乙醇体积分数、解吸液 pH 对静态吸附及解吸 E A 515 f (5)
附的影响。参数考察范围分别为:吸附液及解吸液 m 1
pH 值 1、2、3、4、5、6;解吸液乙醇体积分数 10%、 式中: A 515 为最大吸收波长下的吸光度; f 为稀释
20%、30%、40%、50%、60%、70%、80%、90%、 倍数; m 为样品质量,g。
1
无水乙醇。 纯度(质量分数)测定方法 [15] :称取纯化与未
1.2.5 动态吸附及解吸附检测 纯化的花青素样品,用 pH 2.0 的柠檬酸水溶液溶解,
将预处理好的树脂湿法装柱(称取 LX-8 大孔 采用 pH 示差法检测溶液中的花青素质量浓度,根
吸附树脂 20.0 g,经测定柱体积为 30 mL),用提 据下式计算纯度 B:
取液(体积分数 20%乙醇水溶液,pH 2.0)充分平 V
B /% 100 (6)
衡,将花青素粗提液 25 mL(pH 2.0,质量浓度 0.30 m 2
g C3G/L)分别以 0.5、1.0、1.5、2.0、2.5 mL/min 式中: 为检测所得的花青素质量浓度,g C3G/L;
的流速上样吸附,待吸附完成后测流出液体积及吸 V 为溶液体积,L; m 为样品质量,g。
2
光度,得到动态吸附率。 1.2.7 林生茜草果实花青素稳定性分析
称取饱和吸附的 LX-8 型大孔吸附树脂 20.0 g, 利用最佳纯化工艺条件下获得的林生茜草果实
上柱,充分平衡后,以去离子水充分洗去杂质,使 花青素配制样液,考察环境因素(光照、温度、pH)
用体积分数 70%乙醇水溶液、pH 2.0(质量浓度 7 g/L 和添加剂(氧化还原剂、金属离子、酸味剂、糖、
柠檬酸溶液调节)的洗脱液〔V(7 g/L 柠檬酸溶 防腐剂)等对花青素稳定性的影响,按照下式计算
液)∶V(乙醇)=25∶ 75〕,分别以 0.5、1.0、1.5、 花青素保留率:
2.0、2.5 mL/min 的流速进行洗脱,每 5 mL 流出液 A
保留率 /% e 100 (7)
收集 1 份,测定流出液的花青素吸光度,绘制洗脱 A 0
曲线,根据曲线确定洗脱流速及洗脱剂用量。 式中:A 为花青素初始吸光度;A 为条件处理后的
e
0
1.2.6 林生茜草果实花青素的色价及纯度测定 吸光度。
研究表明,花青素在 500~520 nm 内有最大吸收 光照:配制质量浓度 0.1 g/L 的花青素水溶液
峰 [13] 。林生茜草果实花青素粗提液紫外-可见吸收光 (pH 3.0),分别置于室内避光、室内日光灯、紫外
谱见图 1。如图 1 所示,林生茜草果实花青素溶液 光(254 nm、365 nm)条件下放置 1 周,每隔 1 d
符合花青素的吸收光谱特性,且在 515 nm 波长下有 测定保留率。