Page 184 - 《精细化工》2021年第7期
P. 184
·1466· 精细化工 FINE CHEMICALS 第 38 卷
和去除率计算结果,将 1.20 g/L 的吸附剂用量作为 量增长较慢。因此,pH=7 被选择为较优 pH 进行后
PVA/SA/KHA/MMT 的优选用量,进行随后的系列 续实验。图 10b 中,Pb(Ⅱ)的吸附变化趋势与 MB
实验。当 PVA/SA/KHA/MMT 用量为 1.20 g/L 时, 的变化趋势类似。图 10b 插图为 Pb(Ⅱ)在不同 pH
MB 和 Pb(Ⅱ)的 Q e 分别为 724.97 和 382.34 mg/g, 下的存在形式分布图。从图 10b 插图可知,当溶液
去除率分别为 86.99%和 91.76%。另外,与 PVA/SA/ 初始 pH>5 时,Pb(Ⅱ)会与溶液中的氢氧根结合生成
KHA 相比,PVA/SA/KHA/MMT 对 MB 和 Pb(Ⅱ)的 沉淀,这会影响后期的测试结果。基于此,最终选
吸附能力和去除率相对优异。这主要是由于将 MMT 择溶液初始 pH = 5 作为较优 pH 进行 Pb(Ⅱ)吸附的
引入吸附剂中,增加了吸附剂的比表面积和吸附位 后续实验,以确保较高的去除率。
点所致。 2.5 吸附动力学考察
2.4 溶液初始 pH 对吸附的影响 以 0.1 mol/L HCl 和 0.1 mol/L NaOH 将 50 mL
在 50 mL MB 和 Pb(Ⅱ)的初始质量浓度分别为 1000 mg/L MB 和 50 mL 500 mg/L Pb(Ⅱ )溶液 pH 分
1000 和 500 mg/L、吸附时间 360 min、吸附温度 别调节为 7 和 5,在吸附剂用量 1.20 g/L 的条件下,
25 ℃、吸附剂用量 1.20 g/L 的条件下,以 0.1 mol/L 考察了不同吸附温度下吸附时间对 MB 和 Pb(Ⅱ)吸
HCl 和 0.1 mol/L NaOH 溶液调节溶液 pH,研究了 附量的影响,结果如图 11a、b 所示。
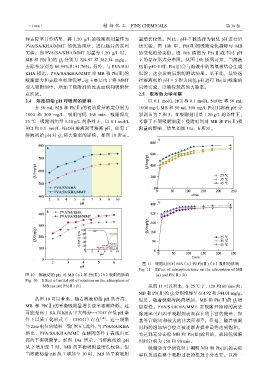
溶液初始 pH 对 Q e 和去除率的影响,如图 10 所示。
图 11 吸附时间对 MB(a)和 Pb(Ⅱ)(b)吸附的影响
Fig. 11 Effect of adsorption time on the adsorption of MB
图 10 溶液初始 pH 对 MB(a)和 Pb(Ⅱ)(b)吸附的影响 (a) and Pb(Ⅱ) (b)
Fig. 10 Effect of initial pH of solution on the adsorption of
MB (a) and Pb(Ⅱ) (b) 从图 11 可以看出,在 25 ℃下,120 和 60 min 内,
MB 和 Pb(Ⅱ)的 Q t 分别增加至 614.92 和 344.01 mg/g。
从图 10 可以看出,随着溶液初始 pH 的升高, 但是,随着吸附时间的增加,MB 和 Pb(Ⅱ)的 Q t 增
MB 和 Pb(Ⅱ)的平衡吸附量增长速率逐渐降低。这 加缓慢。PVA/SA/KHA/MMT 在吸附开始时的高去
可能是由于 SA 和 KHA 中大部分—COO 在低 pH 条 除速率可归因于吸附剂表面存在的丰富的羧基、羟
件下以质子化形式(—COOH)存在 [18] 。这一现象 基等官能团和较大的比表面积 。但是,随着吸附
[5]
与 Zeta 电位的结果一致(图 6)。此外,与 PVA/SA/KHA 时间的增加结合位点被逐渐占据并最终达到饱和。
相比,PVA/SA/KHA/MMT 在相同条件下表现出更 为达到充分去除 MB 和 Pb(Ⅱ)的目的,故较优吸附
高的平衡吸附量。如图 10a 所示,当溶液初始 pH 时间分别为 150 和 90 min。
从 2 增加至 7 时,MB 的平衡吸附量增长较快。但 吸附动力学研究对于阐明 MB 和 Pb(Ⅱ)的去除
当溶液初始 pH 从 7 增加至 10 时,MB 的平衡吸附 率以及追踪整个吸附过程的机理十分重要。以准一