Page 163 - 《精细化工》2022年第1期
P. 163
第 1 期 马天怡,等: L-精氨酸/L-赖氨酸改性大豆分离蛋白乳化性 ·153·
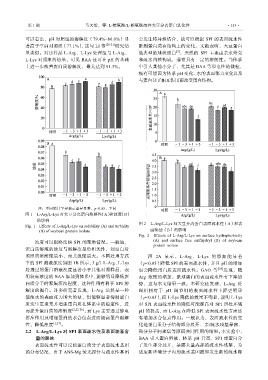
可以看出,pH 对照组的溶解度(79.4%~86.0%)显 会发生特异性结合,故可以根据 SPI 的表面疏水性
著高于空白对照组(77.1%),这与 LI 等 [20-21] 研究结 推测蛋白质在结构上的变化。文献表明,大豆蛋白
[9]
果类似。对比样品 L-Arg、L-Lys 处理组与 L-Arg、 是典型的球状蛋白 ,天然的 SPI 主要由亲水外壳
L-Lys 对照组的结果,可见 BAA 还可在 pH 的基础 和疏水内核构成,通常具有一定的溶解性。当体系
上进一步改善蛋白质溶解度,最大达到 91.3%。 中引入其他小分子,尤其是 BAA 等带电性的微粒,
极有可能因为体系 pH 变化、水的表面张力变化以及
与蛋白分子相互作用而改变蛋白结构。
注:不同统计字母表示差异显著,p<0.05,下同
图 1 L-Arg/L-Lys 对大豆分离蛋白溶解性(A)和浊度(B)
的影响
Fig. 1 Effects of L-Arg/L-Lys on solubility (A) and turbidity 图 2 L-Arg/L-Lys 对大豆分离蛋白表面疏水性(A)和表
(B) of soybean protein isolate 面巯基(B)的影响
Fig. 2 Effects of L-Arg/L-Lys on surface hydrophobicity
浊度可以粗略反映 SPI 的聚集情况。一般地, (A) and surface free sulfhydryl (B) of soybean
protein isolate
蛋白质溶液的浊度与溶解度呈负相关性,如空白对
照组的溶解度最小,而其浊度最大。不同处理方式 图 2A 显示, L-Arg、 L-Lys 的添加 能显著
下的 SPI 溶液浊度如图 1B 所示,3 g/L L-Arg、L-Lys (p<0.05)降低 SPI 的表面疏水性,并且 pH 的增加
处理过的蛋白溶液浊度显著小于其他对照样品,表 也会降低蛋白质表面疏水性。GAO 等 [28] 发现,随
明较高浓度的 BAA 添加到体系中,能够明显降低蛋 Arg 浓度的增加,肌球蛋白的表面疏水性有下降趋
白质分子的聚集浑浊程度,这种作用有利于 SPI 溶 势,这与本文结果一致。本研究还发现,L-Arg 处
解度的提升。许多研究者发现,L-Arg 虽然是一种 理组相对于 pH 调节组的表面疏水性下降更明显
能使水的表面张力增大的盐,但能够显著抑制蛋白 (p<0.05),而 L-Lys 降低的效果不明显,说明 L-Lys
质发生重聚集并增强蛋白质在体系中的稳定性,进 对 SPI 表面疏水性的降低可能源自对 SPI 所处环境
而提升蛋白质的溶解度 [2,22-26] ;而 Lys 主要通过静电 pH 的提高,而 L-Arg 在降低 SPI 表面疏水性方面还
排斥作用及增加蛋白的水合位点进而提高蛋白溶解 有增加水合位点作用。一般认为,表面疏水性的变
性,降低浊度 [1,27] 。 化是蛋白质分子结构部分展开、亲/疏水残基暴露、
2.2 L-Arg/L-Lys 对 SPI 表面疏水性及表面巯基含 部分分子间聚集等原因共同作用的结果。本实验中,
量的影响 BAA 引入蛋白溶液,体系 pH 升高,SPI 球蛋白分
表面疏水性可以反映蛋白质分子表面疏水基团 子发生部分展开,暴露大量内部的疏水性残基,为
的分布情况,由于 ANS-Mg 荧光探针与疏水性基团 适应新环境分子内的疏水基团随即发生新的疏水相