Page 164 - 《精细化工》2022年第1期
P. 164
·154· 精细化工 FINE CHEMICALS 第 39 卷
互作用,引起蛋白质表面疏水性的降低,而分子间 后的 SPI 溶解度提高、浊度降低(图 1)的结果基
由于较强的静电斥力无法靠近,因而,SPI 保持了 本一致。
较高的溶解度和较低的浊度。
另外,L-Arg、L-Lys 添加到蛋白溶液后,这两
种氨基酸带正电荷。一方面,带正电的氨基酸会与
蛋白质表面带负电荷的残基(主要是酸性氨基酸侧
链残基,如谷氨酸和天冬氨酸)发生静电结合 [20] ;
另一方面,L-Arg、L-Lys 也可能与芳香族氨基酸残基
酪氨酸(Tyr)、苯丙氨酸(Phe)、色氨酸(Trp)发生
特异性结合,主要是 L-Arg 的胍基和 L-Lys 的 ε-NH 2
与芳香族氨基酸残基发生阳离子-π 相互作用 [29-30] 。这
两方面均能促进形成蛋白质-BAA 复合物,提高蛋
白分子靠近、进一步聚集的能垒,故能稳定单个蛋
白质分子。
图 2B 表明, L-Arg、 L-Lys 的添 加能 显著
(p<0.05)降低 SPI 的巯基数量,并且质量浓度均
为 3 g/L 的 L-Arg、L-Lys 在降低巯基数量方面效果
相近。同表面疏水性的变化类似,对比空白对照组
和 pH 对照组,可以发现巯基数量也随 pH 的上升而
降低;对比 L-Arg、L-Lys 处理组和对应的 pH 对照
组,可以看出这两种氨基酸在降低表面巯基含量方
面的作用更加显著,这可能使表面巯基与加入的
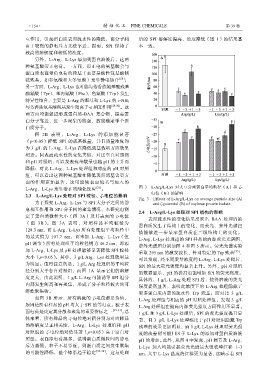
L-Arg、L-Lys 发生潜在的酯化反应 [31] 。 图 3 L-Arg/L-Lys 对大豆分离蛋白平均粒径(A)和 ζ-
电位(B)的影响
2.3 L-Arg/L-Lys 处理对 SPI 粒径、ζ-电位的影响
Fig. 3 Effects of L-Arg/L-Lys on average particle size (A)
为了探究 L-Arg、L-Lys 与 SPI 大分子之间的静 and ζ-potential (B) of soybean protein isolate
电相互作用和 SPI 分子间的聚集情况,本研究也测
2.4 L-Arg/L-Lys 处理对 SPI 结构的影响
定了蛋白质微粒大小(图 3A)及其表面的 ζ-电位
表面疏水性的变化结果反映出 BAA 处理后的
(图 3B)。图 3A 表明,对照样品平均粒径为
蛋白质发生了结构上的变化,而荧光、紫外光谱扫
128.3 nm,而 L-Arg、L-Lys 所有处理组平均粒径中
描能够进一步显示蛋白质在三级结构上的变化。
的最大值为 107.7 nm,而未加 L-Arg、L-Lys(但
L-Arg、L-Lys 处理过的 SPI 样品的内源荧光光谱图、
pH 调节)所有处理组平均粒径则为 46.2 nm,即添
紫外光谱图分别如图 4 和图 5 所示。荧光光谱实验
加 L-Arg、L-Lys 及 pH 处理能够显著降低 SPI 粒径
采取 295 nm 的激发波长,针对特定的 Trp 残基 [35] ,
大小(p<0.05)。其中,3 g/L Arg、Lys 处理效果最
可以发现,经不同质量浓度的 L-Arg、L-Lys 处理后,
为明显。值得注意的是,1 g/L Arg 处理组的平均粒
SPI 的最大荧光强度均显著上升。另外,pH 对照组
径分别大于各自对照组,而图 1A 显示它们的溶解
的数据显示,pH 的提高也能增加 SPI 的荧光强度。
度更大,由此说明,1 g/L L-Arg 可能诱导 SPI 组分
具体的,1 g/L L-Arg 处理 SPI 后,使得溶液的荧光
内部发生解离和再聚集,形成了分子粒径较大的可
强度提高显著,表明此浓度下的 L-Arg 处理隐藏了
溶性聚集物。
更多蛋白质内部的疏水性 Trp 残基;而对比 3 g/L
如图 3B 所示,所有溶液的 ζ-电位都是负值, L-Arg 处理组与相应的 pH 对照处理组,发现 3 g/L
原因是所有样品的 pH 均大于 SPI 的等电点。粒子表 L-Arg 处理组在提高内源荧光强度方面作用不显著。
面电荷是决定其分散和聚集的重要指标之一 [32-33] 。总 1 g/L 和 3 g/L L-Lys 处理后,SPI 的荧光强度提升显
体来看,所有样品的 ζ-电位绝对值分别与对应样品 著,且 3 g/L L-Lys 处理相比于 pH 对照组隐藏 Trp
的溶解度呈正相关性,L-Arg、L-Lys 处理组和 pH 残基的效果更加明显,而 1 g/L L-Lys 处理对荧光强
对照组的 ζ-电位绝对值显著(p<0.05)高于空白对 度的改善则可能归因于 L-Lys 的添加对蛋白质溶液
照组。表面净电荷越多,说明蛋白质微粒间的静电 pH 的增加。此外,从图 4 中发现,pH 调节及 L-Arg、
斥力越强,粒子不易靠近,则蛋白质之间发生聚集 L-Lys 加入均能引起荧光光谱最大吸收峰红移 1~3
的可能性降低,整个体系趋于稳定 [33-34] ,这与处理 nm,其中 L-Lys 造成的红移更为显著,这暗示着 SPI