Page 153 - 《精细化工》2022年第12期
P. 153
第 12 期 李明月,等: Fe 掺杂 Bi 12 TiO 20 光催化剂的制备及光催化性能 ·2519·
如图 7 所示,BTO 和 2% Fe-BTO 在 120 min 的 将测试后的体系进行离心分离,将得到的催化
降解率分别为 54.77%和 40.81%,随着 Fe 含量的增 剂用去离子水和无水乙醇洗涤 3 次后在 60 ℃下干
加,大大提高了光催化反应速率,5% Fe-BTO 在 燥 12 h,得到循环后的 5% Fe-BTO。由图 9 可知,
120 min 对 MB 的降解率达到 98.95%,与纯 BTO 相 经过 5 次循环实验,催化剂对 MB 的降解性能略有
比,5% Fe-BTO 对 MB 降解率提高了 44.18%。经过 降低,对 MB 的降解率仍可达到 88%以上。这可能
30 min 暗反 应后,8% Fe-BTO 的降解率和 5% 是由于在洗涤和离心过程中催化剂的少量损失造
Fe-BTO 区别不大,而随着光反应时间的增加,两者 成的,也可能是因为少量的 MB 残留在催化剂表面,
的降解率相差较大,当 Fe 含量超过 5%后,降解能 占据了部分活性位点。但是仍证明 5% Fe-BTO 可作
力减弱。结合性能测试和上述 BTO 比表面积数据 为一种具有良好循环稳定性能的光催化剂,这充分
看,较小的比表面积并没有影响对染料的去除性能, 说明 Fe 掺杂有助于光催化剂保持良好的稳定性 [29] 。
所以增加的可能是无效比表面积。 2.8 降解机理
光催化反应可视为一级动力学反应,不同 Fe
对 Fe-BTO 光催化去除 MB 提出了一种可能的
掺杂量的光催化剂的反应速率常数由方程 ln(ρ 0 /ρ)=
降解机制,如图 10 所示。BTO 受到光照且入射光
Kt 计算,其中 ρ 0 /ρ 代表一定反应时间前后的质量浓 的光子能量大于 2.731 eV 时,光子才会被 BTO 吸收,
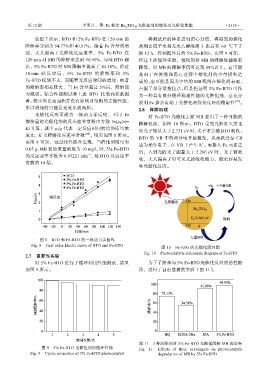
度比,K 为降解反应速率常数 [28] 。结果如图 8 所示。
BTO 的 VB 中的部分电子被激发,从而跃迁至 CB
由图 8 可知,经过线性拟合发现,当催化剂用量为
+
成为光生电子,在 VB 上产生 h 。而掺入 Fe 元素之
0.05 g、MB 初始质量浓度为 10 mg/L 时,5% Fe-BTO 后,入射光的光子能量大于 2.266 eV 时,光子被吸
–1
的反应速率常数为 0.03221 min ,是 BTO 反应速率
收,大大提高了对可见光的吸收能力,能更容易发
常数的 10 倍。
生光催化反应。
图 8 BTO 和 Fe-BTO 的一级动力学曲线
Fig. 8 First order kinetic curve of BTO and Fe-BTO 图 10 Fe-BTO 的光催化原理图
2.7 重复性实验 Fig. 10 Photocatalytic schematic diagram of Fe-BTO
对 5% Fe-BTO 进行了循环利用性能测试,结果 为了了解参与 5% Fe-BTO 光催化反应的活性物
如图 9 所示。 质,进行了自由基捕获实验(图 11)。
图 11 3 种清除剂对 5% Fe-BTO 光催化降解 MB 的影响
图 9 5% Fe-BTO 光催化剂的循环性能 Fig. 11 Effects of three scavengers on photocatalytic
Fig. 9 Cyclic properties of 5% Fe-BTO photocatalyst degradation of MB by 5% Fe-BTO