Page 14 - 《精细化工)》2023年第10期
P. 14
·2092· 精细化工 FINE CHEMICALS 第 40 卷
进行了随机 ICP-MS 分析,证明每个 ClFDH 亚单位有 S. fumaroxidans、D. vulgaris 和 D. desulfuricans 的甲
+
+
1.28 个钨,说明 ClFDH 是一种依赖 NAD 并且含金属 酸脱氢酶均是 NAD(P) /金属辅因子依赖型 FDH。因
钨的酶。OLIVEIRA 等 [27] 根据 Desulfovibrio vulgaris 此,后续研究如果是以 CO 2 固定还原为目标的工作,
Hidenborough 中的 DvFDH,构建了一个重组的含钨的 可以重点围绕金属辅因子依赖型 FDH 开展。
甲酸脱氢酶(FdhAB,含有两个不同亚基 A 和 B 的
FDH),表现出显著的 O 2 稳定性。此外,DvFDH 表现 2 甲酸脱氢酶的活性位点及其催化机制
–1
出非常高的 CO 2 还原活性,其 k cat 值为 315 s ,k cat /K m
近年来,许多科研工作者都在尝试通过基因工
值为 750 L/(mmols)。
+
根据文献报道,一些 NAD 依赖型 FDH 的 T m 值 程和酶工程的手段对 FDH 进行定向改造,以提高其
CO 2 的还原活性。而充分了解 FDH 的结构和催化机
(即热处理后初始酶活性损失 50%时的温度)在
+
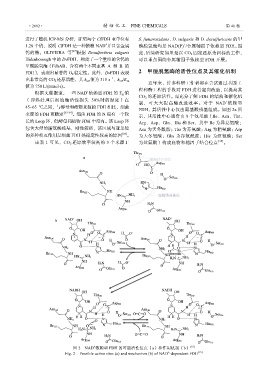
制,可大大提高酶改造效率。对于 NAD 依赖型
45~65 ℃之间,与酵母和植物来源的 FDH 相比,细菌 FDH,其活性中心仅由氨基酸残基组成。如图 2a 所
来源的 FDH 更稳定 [32-34] 。细菌 FDH 的 N 端有一个较
示,其活性中心通常由 8 个氨基酸(Ile、Asn、Thr、
长的 Loop 环,但酵母和植物 FDH 中没有。该 Loop 环 Arg、Asp、Gln、His 和 Ser,其中 Ile 为异亮氨酸;
包含大量的脯氨酸残基,刚性较强,该区域与亚单位 Asn 为天冬酰胺;Thr 为苏氨酸;Arg 为精氨酸;Asp
的多种相互作用是细菌 FDH 热稳定性较高的原因 [18] 。 为天冬氨酸;Gln 为谷氨酰胺;His 为组氨酸;Ser
由表 1 可见,CO 2 还原效率较高的 3 个来源于 为丝氨酸)构成底物和辅因子结合位点 [35] 。
+
图 2 NAD 依赖型 FDH 的可能活性位点(a)和作用机制(b) [15]
+
Fig. 2 Possible active sites (a) and mechanism (b) of NAD -dependent FDH [15]