Page 238 - 《精细化工》2023年第3期
P. 238
·694· 精细化工 FINE CHEMICALS 第 40 卷
当 n(离子液体)∶n(芳甲醇)>1∶1 时,Ⅱa 产率变化 生(表 1 序号 1、图 1)。说明离子液体与 O 2 协同作
不明显。因此,选择 n(离子液体)∶n(芳甲醇)=1∶1 用于苯甲醇羟基才可发生脱氢反应。DFT 计算证明,
为适宜离子液体用量。 苯甲醇羟基氢与离子液体阴离子氧原子之间存在强
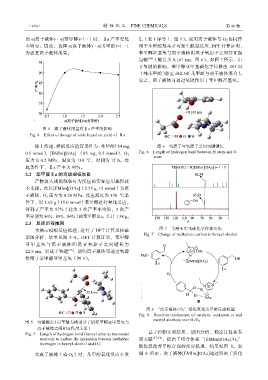
氢键 [26] (键长为 0.167 nm,图 6)。如图 7 所示,由
于氢键的影响,苯甲醇亚甲基碳化学位移由 δ63.24
(纯苯甲醇)移至 δ62.54(苯甲醇与离子液体混合)。
总之,离子液体可通过氢键作用于苯甲醇羟基氢。
图 4 离子液体用量对Ⅱa 产率的影响
Fig. 4 Effect of dosage of ionic liquid on yield of Ⅱa
综上所述,模板反应适宜条件为:苯甲醇(54 mg, 图 6 氢原子与氧原子之间氢键键长
Fig. 6 Length of hydrogen bond between H atom and O
0.5 mmol)、[EMIm][OAc] (85 mg, 0.5 mmol)、O 2
atom
压力为 0.2 MPa、温度为 130 ℃、时间为 12 h。在
此条件下,Ⅱa 产率为 90%。
2.2 苯甲醛Ⅱa 的克级规模制备
产物放大规模制备可为反应的实际应用提供技
术支撑。在以[EMIm][OAc](2.55 g, 15 mmol)为离
子液体、O 2 压力为 0.20 MPa、反应温度为 130 ℃条
件下,对 1.62 g(15.0 mmol)苯甲醇进行氧化反应,
得到了产率为 87%(此为 3 次产率平均值,3 次产
率分别为 86%、89%、86%)的苯甲醛Ⅱa,共计 1.38 g。
2.3 反应历程推测
为揭示模板反应机理,进行了 DFT 计算及核磁 图 7 苄醇亚甲基碳化学位移变化
Fig. 7 Change of methylene carbon in benzyl alcohol
谱图分析,结果见图 5~8。DFT 计算证明,苯甲醇
亚甲基氢与离子液体阴离子氧原子之间键长为
22.8 nm,形成了氢键 [26] ,说明离子液体可通过氢键
作用于苯甲醇亚甲基氢(图 5)。
图 8 “离子液体/ O 2 ”催化氧化芳甲醇反应机理
Fig. 8 Reaction mechanism of catalytic oxidation of aryl
methyl alcohols over IL/O 2
图 5 氢键键长(以苄醚为模型分子研究苄醇亚甲基氢与
离子液体之间相互作用关系)
Fig. 5 Length of hydrogen bond (benzyl ether as the model 基于控制实验结果、谱图分析、理论计算和参
molecule to explore the interaction between methylene 照文献 [17-18] ,提出了组合体系“[EMIm][OAc]/O 2 ”
hydrogen in benzyl alcohol and IL) 催化氧化芳甲醇合理的反应机理,结果见图 8。如
无离子液体(或 O 2 )时,苯甲醇氧化反应不发 图 8 所示,离子液体[EMIm][OAc]通过阴离子活化