Page 189 - 201810
P. 189
第 10 期 卜 鑫,等: 基于分子修饰 C-COS 的高吸湿保湿机理 ·1797·
水的影响。 号幅值 A 22 代表自由水,τ 2 弛豫时间相对较长且范围
13
1.3.3 核磁共振碳谱( CNMR)测试 为 τ 22 (5~1000 ms) [10-11] 。壳寡糖随着吸湿时间的
称取 100 mg 样品分别溶于 0.6 mL 的 DMSO、 增加,A 21 峰面积逐渐增加且 τ 21 向长的弛豫时间移
D 2 O 和体积分数分别为 5%、17%、28%、37% 动,A 22 峰面积和 τ 22 弛豫时间无明显变化。相比较
H 2 O/DMSO 混合溶剂中,采样条件为:采用 30°脉 之下,羧基化壳寡糖的 A 21 峰面积增加趋势要明显
冲序列,采样时间 1.36 s,弛豫时间 1.89 s,累积扫 高于壳寡糖,其具体表现在 48 h 处 A 21 峰的信号幅
描 15000 次。 值由 238 AU 增强到 282 AU,说明了改性羧基化壳
寡糖的吸湿能力明显增强,吸湿过程中水分子主要
2 结果与讨论
以结合水的形式与多糖类聚合物分子相连接,间接
地表明了物质的吸湿作用属于化学键作用力,即分
2.1 低场核磁共振分析
子间氢键作用。
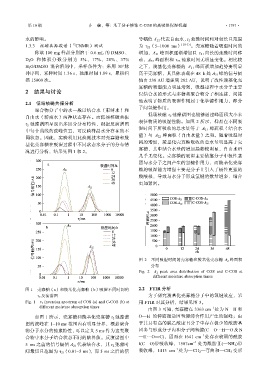
聚合物分子中的水一般以结合水(束缚水)和
低场核磁 τ 2 弛豫谱图也能够通过峰面积大小来
自由水(游离水)两种状态存在。而低场核磁共振
表征物质的吸湿性能。如图 2 所示,样品在不同吸
τ 2 弛豫谱图呈现出多组分分布特性,根据反演谱图
湿时间下所吸收的总水量等于 A 21 峰面积(结合水
中每个曲线的波峰位置,可反映样品水分存在的不
量)与 A 22 峰面积(自由水量)之和。随着吸湿时
同状态。因此,实验利用此检测技术对壳寡糖和羧
间的增加,羧基化壳寡糖吸收的总水量明显高于壳
基化壳寡糖在吸湿过程中不同状态水分子的分布情
寡糖,其中结合水量的增加趋势较明显,自由水量
况进行分析,结果见图 1 和 2。
几乎无变化。壳寡糖的吸湿主要依靠分子中极性基
团与水分子之间产生的氢键作用力,而羧基化壳寡
糖的吸湿能力增强主要是分子上引入了极性更强的
羧酸根,导致与水分子形成氢键的数量增多、结合
更加紧密。
图 2 不同吸湿时间的壳寡糖和羧基化壳寡糖 A 2 峰面积
分布
Fig. 2 A 2 peak area distribution of COS and C-COS at
different moisture absorption times
图 1 壳寡糖(a)和羧基化壳寡糖(b)吸湿不同时间的 2.2 FTIR 分析
τ 2 反演谱图 为了研究羧基化壳寡糖分子中的氢键效应,采
Fig. 1 τ 2 inversion spectrum of COS (a) and C-COS (b) at 用 FTIR 对其分析,结果见图 3。
different moisture absorption times 由图 3 可知,壳寡糖在 3363 cm 处为 N—H 和
–1
如图 1 所示,壳寡糖和羧基化壳寡糖 τ 2 弛豫谱 O—H 的伸缩振动因氢键缔合作用产生的强峰;由
图的波峰在 1~10 ms 范围内有明显分界,根据聚合 于其具有高的脱乙酰度且分子中存在极少的酰胺基
物分子水分的弛豫特性,可以定义 5 ms 作为这类聚 团参与形成分子内和分子间氢键(C==O···H—O 及 N
–1
合物中水分子结合状态不同的临界值。反演谱图中 —H···O==C),因而在 1641 cm 处存在较弱的酰胺
5 ms 之前的信号幅值 A 21 代表结合水,其 τ 2 弛豫时 I(C==O)带吸收峰,1587cm –1 处为酰胺Ⅱ(—NH 2 )带
–1
间最短且范围为 τ 21 (0.01~5 ms),而 5 ms 之后的信 吸收峰,1413 cm 处为—CH 2 —弯曲和—CH 3 变形