Page 74 - 201812
P. 74
·2042· 精细化工 FINE CHEMICALS 第 35 卷
如图 1 所示,以大肠杆菌基因组为模板,通过 2.4 重组 L-苏氨酸醛缩酶酶学性质研究
PCR 扩增获得大小约为 1000 bp 的核酸条带,与理 2.4.1 温度对酶活性的影响
论大小相符。重组质粒 pGEX-KG-ltaE 用 BamHI 和 温度过低时酶活性较低,温度升高时酶活性随
EcoRI 限制性内切酶双酶切,经琼脂糖凝胶电泳验 之升高,酶促反应速度加快。而温度过高时又会导
证,获得大小约为 5000 和 1000 bp 的条带,长度分 致酶活性急剧下降,甚至导致酶蛋白变性失活。因
别与 pGEX-KG 载体和 ltaE 基因相符。重组质粒中 此,酶促反应的最适反应温度是综合平衡的结果。
的 ltaE 基因以 pGEX-KG 质粒通用引物测序,与目 温度对重组 L-TA 活性的影响如图 3 所示。
的基因序列一致,上述结果表明 ltaE 基因已成功连
接到 pGEX-KG 载体上。
2.2 重组 L-TA 蛋白诱导表达
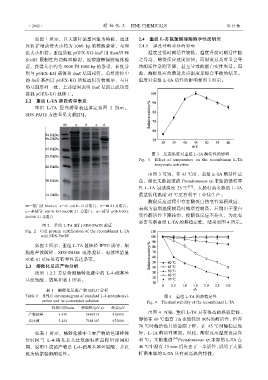
重组 L-TA 蛋白诱导表达鉴定如图 2 所示。
SDS-PAGE 方法参见文献[23]。
图 3 反应温度对重组 L-TA 酶活性的影响
Fig. 3 Effect of temperature on the recombinant L-TA
enzymatic activities
由图 3 可知,在 45 ℃时,重组 L-TA 酶活性最
高,相比文献报道的 Pseudomonas sp.来源的低特异
性 L-TA 最适温度 25 ℃ [14] ,大肠杆菌来源的 L-TA
最适转化温度 45 ℃更有利于工业化生产。
酶促反应过程中存在酶蛋白热变性累积效应,
M—蛋白质 Marker;a—E. coli K-12 总蛋白;b—BL21 总蛋白; 表现为前期温度较高时酶活性较高,后期由于蛋白
c—未诱导 pGEX-KG-ltaE/BL21 总蛋白;d—诱导 pGEX-KG-
ltaE/BL21 总蛋白 变性酶活性下降较快,使酶促反应不持久,为此有
必要考察重组 L-TA 的热稳定性,结果如图 4 所示。
图 2 重组 L-TA 蛋白 SDS-PAGE 验证
Fig. 2 Cell protein certification of the recombinant L-TA
with SDS-PAGE
如图 2 所示,重组 L-TA 菌株经 IPTG 诱导、细
胞超声波破碎、SDS-PAGE 电泳验证,电泳图谱显
示在 61 kDa 处有特异性表达条带。
2.3 酶催化反应产物分析
按照 1.2.2 方法检测酶转化液中的 L-4-硝基苯
基丝氨酸,结果如表 1 所示。
表 1 酶催化反应产物 HPLC 分析
Table 1 HPLC chromatogram of standard L-4-nitrophenyl- 图 4 重组 L-TA 的热稳定性
serine and its conversion solution Fig. 4 Thermal stability of the recombinant L-TA
保留时间/min 峰面积/(μV·s) 峰高/μV
由图 4 可知,重组 L-TA 具有很高的热稳定性,
产物标样 5.430 5440319 810810
反应液 5.424 7288185 975088 即使在 60 ℃温育 1 h 也能保留 80%的酶活性,但在
70 ℃时酶活性开始急剧下降,在 45 ℃时酶稳定性
如表 1 所示,酶转化液中主要产物的色谱峰保 好,L-TA 酶活性更高。因此,酶促反应温度设定在
留时间与 L-4-硝基苯基丝氨酸标准品保留时间相 45 ℃。文献报道 [14] Pseudomonas sp.来源的 L-TA 在
同,说明生成的产物是 L-4-硝基苯基丝氨酸,并以 40 ℃中温育 15 min 后失去了一半活性,说明了大肠
此为依据检测酶活性。 杆菌来源的 L-TA 具有耐高温的特性。