Page 68 - 201808
P. 68
·1316· 精细化工 FINE CHEMICALS 第 35 卷
50 mL 底物溶液添加 2.5 g 壳聚糖固定化细胞,在 型以及缓冲体系的离子强度等都会对反应过程产生
37 ℃、200 r/min 下搅拌反应,反应过程中滴加稀盐 影响。反应体系 pH 和缓冲体系类型对壳聚糖固定
酸维持 pH=6.6。 化细胞催化 IDA 合成的影响见图 2。
1.2.8 HPLC 测定 IDA
采用柱前衍生法测定 IDA 的含量 [10-11] 。取 100 µL
样品置于 15 mL 试管中,依次加入 2 mL 0.25 mol/L
NaHCO 3 溶液,0.4 mL 质量分数 1%的 2,4-二硝基
氟苯乙腈溶液。在 60 ℃下水浴 30 min。HPLC 检测
前加入 7.5 mL 纯净水。使用的分析柱为 Agilent
XDB-C18 柱,UV 检测器,流动相为〔V(甲醇)∶
V(0.05 mmol/L NaAc-HAc 缓冲液,pH=5.0)〕=55∶
45,流速为 0.8 mL/min,波长为 365 nm,进样量为
10 µL。
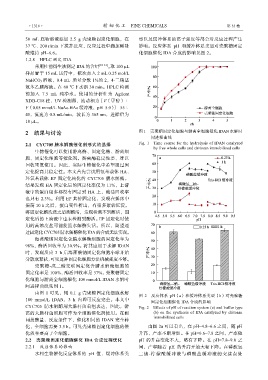
2 结果与讨论 图 1 壳聚糖固定化细胞与游离全细胞催化 IDAN 水解时
间进程曲线
2.1 CYC705 腈水解酶催化剂形式的选择 Fig. 1 Time course for the hydrolysis of IDAN catalyzed
by free whole cells and chitosan immobilized cells
生物催化可以使用游离酶、固定化酶、游离细
胞、固定化细胞等催化剂。游离酶稳定性差、难以
回收重复使用。因此,实际生物催化中希望通过固
定化提高其稳定性。本文首先尝试用氨基载体 HA、
环氧基载体 EP 固定化纯化的 CYC705 腈水解酶。
结果发现 HA 固定化后的固定化率仅为 11%,上清
液中的蛋白很多都没有固定到 HA 上,酶活回收率
也只有 2.3%。利用 EP 共价固定化,发现在摇床中
振荡 10 h 之后,蛋白变性析出,有很多絮状沉淀。
将固定化酶洗涤之后测酶活,发现检测不到酶活,固
定化后的上清液中也未检测到酶活。EP 固定化时使
用的高浓度盐可能使腈水解酶失活。所以,期望通
过固定化CYC705 腈水解酶催化IDA 的合成无法实现。
海藻酸钠固定化含腈水解酶细胞的固定化率为
98%,酶活回收率为 30.9%。将其应用于水解 IDAN
时,发现反应 3 h 后海藻酸钠固定化细胞小球开始
分散成絮状,可见这种固定化细胞方法机械强度不够。
壳聚糖-戊二醛交联固定化含腈水解酶细胞的
固定化率是 100%,酶活回收率是 37%。壳聚糖固定
化细胞与游离全细胞催化 100 mmol/L IDAN 水解时
间进程曲线见图 1。
由图 1 可见,用 0.1 g 壳聚糖固定化细胞水解
图 2 反应体系 pH(a)和缓冲体系类型(b)对壳聚糖
100 mmol/L IDAN,3 h 内即可反应完全。本文中
固定化细胞催化 IDA 合成的影响
CYC705 腈水解酶用大肠杆菌重组表达,因此,游 Fig. 2 Effects of pH of reaction system (a) and buffer type
离的大肠杆菌细胞可作为全细胞催化剂使用。在相 (b) on the synthesis of IDA catalyzed by chitosan
immobilized cells
同投酶量、反应条件下,催化相同的 IDAN 完全转
化,全细胞需要 3.5 h。可见壳聚糖固定化细胞的催 由图 2a 可以看出,在 pH=4.8~6.6 之间,随 pH
化效率要高于全细胞。 升高,产率不断增加。在 pH=6.6~7.8 之间,产率随
2.2 壳聚糖固定化细胞催化 IDA 合成过程优化 pH 的升高变化不大,略有下降。在 pH=7.8~9.0 之
2.2.1 反应体系的影响 间,产率随着 pH 的升高开始大幅下降。在磷酸氢
水相生物催化反应体系的 pH 值、缓冲体系类 二钠-柠檬酸缓冲液与磷酸盐缓冲液的交接点处