Page 29 - 201902
P. 29
第 2 期 程玉桥,等: 磷酸型化合物设计合成方法研究进展 ·195·
酯与酮的不对称 Michaels 加成反应。并验证在最佳 2014 年,Guin [13] 等报道了一种催化对映选择性
反应条件下具有较为广泛的底物适用性,产物(ⅩⅤ) Abramov 反应。以 2-萘甲醛、二乙基三甲基甲硅烷
产率均在 83%~99%。但是没能成功分离最终目标产 基亚磷酸酯为反应底物,以手性二磺酰亚胺作催化
物的两对非对映异构体,也没有确定其产物的构型。 剂,合成了几种官能团化的 α-羟基膦酸酯(ⅩⅥ),
反应路线如下,机理见图 4。 产率高达 98%。实验原料量可缩放,在温和反应条
件下可以应用于 1 g 原料。并且有效避免了使用金
属催化的缺点。反应路线如下:
2015 年,赵亚磊 [33] 首次报道了将传统合成 α-
羟基膦酸酯的方法与氧化还原转化反应结合,用不
饱和醛化合物制备 α-酰氧基膦氧化合物。以二丁基
膦氧与肉桂醛作反应底物,在希莱克管中反应,产
率达 86%。反应由碱协助的氧化还原体系,无需过
渡金属或氮杂环卡宾催化,无需借助腈基化试剂,
二烷基膦氧和不饱和醛反应合成一系列 α-酰氧基膦
氧化合物(ⅩⅦ)。反应具有氧化还原转化过程中
的原子经济性、氧化还原经济性和步骤经济性的优
点,并避免了使用酰氯试剂带来的缺点(步骤经济
性差,副产物对环境不友好)。反应路线如下:
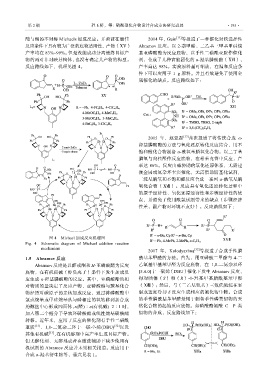
图 4 Michael 加成反应机理图
Fig. 4 Schematic diagram of Michael addition reaction
mechanism 2017 年,Kolodyazhna [32] 等报道了合成手性膦
1.5 Abramov 反应 酰基苯甲醛的方法。首先,用亚磷酸二甲酯与 4-二
Abramov 反应是以醛或酮和 H-亚磷酸酯为反应 乙氧基甲基苯甲醛为反应底物,在 1,8-二氮杂双环
底物,在有机强碱(醇负离子)条件下发生加成反 [5.4.0]十一碳烯(DBU)催化下发生 Abramov 反应,
应生成 α-羟基膦酸酯的反应。其中,亚磷酸酯的相 得对映体(S)和(R)-1-羟基甲基膦酰基苯甲醛
对物质的量决定了反应产物,亚磷酸酯与羰基化合 (ⅩⅧ);然后,与(二乙基氨基)三氟代硫烷在室
物经历对碳原子的亲核加成反应,通过将磷酸酯中 温或适度冷却下反应生成相应的氟化衍生物。合成
氢或烷基或甲硅烷基从与磷相连的氧转移到新合成 的手性膦酰基苯甲醛是用于制备手性磷类似物的天
的醇盐中心形成四面体,n(醛)∶n(有机碱)=2∶1 时, 然化合物的起始反应底物。如磷酸酪氨酸 C—P 类
加入第二个醛分子导致环磷酸酯或线性烷基磷酸酯 似物的合成,反应路线如下:
转移。近年来,应用于反应的催化剂有手性二磺酰
亚胺 [13] 、1,8-二氮杂二环十一碳-7-烯(DBU) [32] 以及
其他有机碱 [33] ,在有机溶剂中高产率生成目标产物。
但无催化剂、无溶剂或者在微波辅助下减少使用有
机试剂的 Abramov 反应并未见相关报道。反应用于
合成 α-羟基衍生物等,通式见表 1。