Page 192 - 201904
P. 192
·718· 精细化工 FINE CHEMICALS 第 36 卷
的表面较为光滑,上面分布着很多现状不规则的网 析结果基本一致。
孔(图 4a、c);(2)多分支链聚集结构。在该结构
中,分支链呈不规则纤维状,互相缠绕、聚集在一
起(图 4b、d)。蛹虫草(Cordyceps militaris)粗多
糖包括不规则的树叶状结构和雪茄形结构两种式
样 [26] 。蛹虫草粗多糖的树叶状结构中也分布着很多
不规则的网孔,与滇黄精多糖的多网孔片状结构十
分接近。蛹虫草粗多糖经过硒化修饰后,其微观形
貌以不规则的树叶状结构为主,表面较为粗糙,网
孔的形状呈较规则的圆形 [26] ,这与滇黄精多糖的多
网孔片状结构差异较大。灰树花(Grifola frondosa)
硒多糖的微观形貌与滇黄精多糖的多分支链聚集结 图 5 滇黄精多糖的热重分析曲线
构较为接近 [27] 。滇黄精多糖的微观形貌可能与多糖 Fig. 5 TGA curve of Polygonatum kingjanttm polysaccharides
分子之间较强的范德华力及其他作用有关 [26] 。
2.5 滇黄精多糖对 α-淀粉酶、α-葡萄糖苷酶的抑制
效应
如图 6 所示,滇黄精多糖质量浓度与 α-葡萄糖
苷酶抑制效应之间存在较好的量效关系。在实验浓
度范围内,随着多糖样品浓度的升高,其对 α-葡萄
糖苷酶的抑制效应也逐渐增强。在 2~6 g/L 质量浓
度时,滇黄精多糖的抑制效应变化最为明显。阿卡
波糖也表现出类似趋势,在 0~0.0022 g/L 质量浓度
内,阿卡波糖的抑制效应随着浓度的升高而不断增
强(图 7)。由表 1 可知,滇黄精多糖对 α-葡萄糖苷
酶的半抑制浓度(IC 50 )为 4.5720 g/L,高于阿卡波
糖(0.0013 g/L),说明滇黄精多糖具有一定的 α-葡
萄糖苷酶抑制效应,但是其抑制活性低于阿卡波糖。
图 4 滇黄精多糖的 SEM 形貌照片 [29]
Fig. 4 SEM images of Polygonatum kingjanttm polysaccharides 阿卡波糖是临床上常用的降血糖药物 ,容易引起
患者胃肠不适、腹泻、腹痛、溃疡等副作用 [30] 。滇
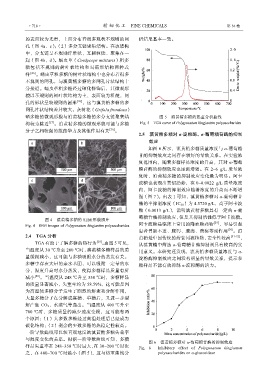
2.4 TGA 分析 黄精是中国传统的药食同源植物,安全性较高 [31-32] ,
TGA 有助于了解多糖的热行为 [28] 。由图 5 可见, 从滇黄精中筛选 α-葡萄糖苷酶抑制剂具有较高的实
当温度从 30 ℃升至 200 ℃时,滇黄精多糖样品的质 用意义。本研究还发现,滇黄精多糖质量浓度与 α-
量缓慢减小,这可能与多糖吸附水分的蒸发有关。 淀粉酶抑制效应之间没有明显的量效关系,提示多
多糖中存在大量的亲水基团,可以吸附一定量的水 糖样品不能有效抑制 α-淀粉酶的活力。
分,温度升高时水分蒸发,使得多糖样品质量有所
减小 [28] 。当温度从 248 ℃升至 350 ℃时,多糖样品
的质量显著减小,失重率约为 58.59%,这可能是因
为高温使多糖分子发生了剧烈的解聚和分解作用,
大量多糖分子在分解成寡糖、单糖后,又进一步裂
解产生 CO 2 、水蒸气等逸出。当温度从 400 ℃升至
700 ℃时,多糖质量的减少速度变慢,这可能有两
个原因:(1)大多数多糖经过高温处理后已经成为
碳化结构;(2)剩余的少数多糖的热稳定性较高。
一阶导数曲线可以较直观地反映滇黄精多糖失重率
与温度变化的关系。根据一阶导数曲线可知,多糖
图 6 滇黄精多糖对 α-葡萄糖苷酶的抑制效应
样品失重率在 248~350 ℃时最大,在 30~200 ℃时次 Fig. 6 Inhibitory effect of Polygonatum kingjanttm
之,在 400~700 ℃时最小(图 5),这与热重曲线分 polysaccharides on α-glucosidase